

D'après The « Domestication Syndrome » in Mammals: A Unified Explanation Based on Neural Crest Cell Behavior and Genetics par Adam S. Wilkins, Richard W. Wrangham, et W. Tecumseh Fitch.
Le « syndrome de domestication » chez les mammifères : une explication unifiée fondée sur le fonctionnement et la génétique de la crête neuraleCet article est composé d'extraits de la publication, que j'ai choisis parce qu'ils m'intéressaient particulièrement et qu'ils étaient simples à comprendre. J'ai notamment supprimé certains passages purement destiné à étayer l'argumentation des auteurs.
Charles Darwin, alors qu'il tentait d'élaborer une théorie générale de l'hérédité à partir des observations d'éleveurs d'animaux et de sélectionneurs de plantes, a découvert que les mammifères domestiqués possèdent un ensemble distinctif de caractéristiques héréditaires que l'on ne retrouve pas chez leurs ancêtres. Certaines de ces caractéristiques apparaissent aussi chez les oiseaux et les poissons domestiques. L'origine du « syndrome de domestication » de Darwin est restée une énigme pendant plus de 140 ans. La plupart des explications se focalisent sur des caractéristiques particulières ou sur les facteurs sélectifs possibles impliqués dans la domestication plutôt que sur les causes génétiques et liées au développement sous-jacentes.
Nous proposons ici que le syndrome de domestication résulte principalement de légers déficits des cellules de la crête neurale formés au cours du développement embryonnaire. La plupart des caractères modifiés, morphologiques comme physiologiques, peuvent être facilement expliqués comme des conséquences directes de ces carences, alors que d'autres caractères peuvent être compris comme des conséquences indirectes.

L'absence d'une théorie de l'hérédité était une lacune majeure dans la théorie de l'évolution de Charles Darwin, telle que présentée dans la 1e édition de L'Origine des espèces. Darwin savait que sa théorie de l'évolution nécessitait une hypothèse précise sur le fonctionnement de l'hérédité biologique mais, en 1859, il n'était pas prêt à en proposer une. Il a ensuite tenté de combler cette lacune dans son importante étude sur l'hérédité « De la variation des animaux et des plantes sous l'action de la domestication ». Rédigée des décennies avant la naissance d'une science de la génétique, elle s'appuyait principalement sur des données produites par des éleveurs d'animaux et des horticulteurs, donc sur des observations d'animaux et de plantes domestiqués.
Se fondant sur son étude sur la sélection des animaux d'élevage, Darwin a découvert que les mammifères domestiques présentaient en général une série de caractéristiques comportementales, physiologiques et morphologiques qui n'avaient pas été observées chez leurs ancêtres sauvages. On sait maintenant que l'ensemble complet de ces caractéristiques comprend :
Comme Darwin l'a reconnu, la cohérence de cet ensemble très diversifié de modifications phénotypiques chez les mammifères domestiqués constitue une énigme majeure. L'ensemble semble refléter un aspect du processus de domestication en tant que tel. Cette déduction est confortée par la découverte que les oiseaux, et même les poissons, domestiqués partagent certains éléments de cet ensemble de traits caractéristiques. Darwin a publié ces découvertes quelques années après la publication des travaux de Mendel : la base héréditaire de ce phénomène constitue donc un des plus anciens problèmes en génétique.
La synthèse des caractéristiques des mammifères domestiqués compose un ensemble nommé syndrome de domestication. Nous présentons ici une nouvelle hypothèse sur la nature et l'origine du SD, en proposant que l'élément sous-jacent qui unifie ses diverses caractéristiques est leur développement via les cellules de la crête neurale, des cellules souches multipotentes qui naissent dans la partie dorsale du tube neural des embryons des vertébrés.
Il existe de nombreuses hypothèses sur la nature du processus de domestication et ses effets sur diverses espèces et races d'animaux domestiques. Cependant, la plupart des explications proposées ne considèrent pas le SD dans sa globalité mais se focalisent au contraire sur des éléments isolés, comme les modifications de couleur de robe ou la taille du museau, en postulant que certaines pressions sélectives imposées par les humains pourraient avoir favorisé ces traits caractéristiques. Si on exclut en outre les caractères sélectionnés délibérément chez certains animaux domestiques, comme une production accrue de viande ou de lait chez les bovins, d'œufs chez les volailles ou la qualité de la laine chez les moutons, le nombre d'explications génétiques des traits caractéristiques des animaux domestiques se restreint encore. Les quelques hypothèses globales proposées au cours des dernières années se sont focalisées sur de possibles caractères sélectifs globaux qui peuvent être liés à la vie en captivité, sans tenter d'apporter des explications génétiques ou mécanistes du syndrome.
Darwin a suggéré 2 explications possibles :
 La 1e, la plus globale, était que les
conditions de
vie plus faciles des animaux domestiqués, notamment l'accès aisé
à une
nourriture améliorée,
induisaient d'une certaine manière ces caractéristiques. Il n'a pas pu
expliquer en quoi cela
devrait précisément concerner toutes les caractéristiques
observées
ni pourquoi d'autres
n'étaient pas produites. Il n'a pas non plus pu préciser la proportion de
caractéristiques du SD
causée par l'environnement à chaque génération, ni quelle
proportion
était devenue héréditaire. Son hypothèse prédisait que les
animaux domestiques
relâchés dans la nature perdraient peu à peu ces caractéristiques.
Les informations
recueillies à partir d'animaux domestiques échappés qu'il a
étudiés étaient confuses. Elles étaient
aussi compliquées par la diminution du taux de survie des animaux domestiques
retournés à l'état
sauvage et, dans certains cas, par leur croisement avec des animaux sauvages apparentés.
Les
données
contemporaines remettent clairement en question l'hypothèse des « conditions de
vie
». P. ex., la taille du cerveau des animaux sauvages domestiqués reste réduite
jusqu'à 40 générations
après le retour à la vie sauvage.
La 1e, la plus globale, était que les
conditions de
vie plus faciles des animaux domestiqués, notamment l'accès aisé
à une
nourriture améliorée,
induisaient d'une certaine manière ces caractéristiques. Il n'a pas pu
expliquer en quoi cela
devrait précisément concerner toutes les caractéristiques
observées
ni pourquoi d'autres
n'étaient pas produites. Il n'a pas non plus pu préciser la proportion de
caractéristiques du SD
causée par l'environnement à chaque génération, ni quelle
proportion
était devenue héréditaire. Son hypothèse prédisait que les
animaux domestiques
relâchés dans la nature perdraient peu à peu ces caractéristiques.
Les informations
recueillies à partir d'animaux domestiques échappés qu'il a
étudiés étaient confuses. Elles étaient
aussi compliquées par la diminution du taux de survie des animaux domestiques
retournés à l'état
sauvage et, dans certains cas, par leur croisement avec des animaux sauvages apparentés.
Les
données
contemporaines remettent clairement en question l'hypothèse des « conditions de
vie
». P. ex., la taille du cerveau des animaux sauvages domestiqués reste réduite
jusqu'à 40 générations
après le retour à la vie sauvage.
 La 2e explication de Darwin était que les
caractéristiques associées
à la
domestication découlaient de
l'hybridation de différentes races, voire d'espèces apparentées.
Effectivement, l'hybridation peut créer de nouvelles propriétés, mais
cette hypothèse n'explique pas pourquoi seuls les traits caractéristiques
spécifiques au SD, et
seulement
eux,
sont observés
chez de multiples espèces. En outre, on a testé expérimentalement
l'hypothèse de l'hybridation et
elle a réfutée comme explication globale chez plusieurs espèces : on a
répété le processus
de domestication essentiellement à partir de géniteurs issus de lignées
sauvages uniques, non
hybrides, et on a quand même obtenu le SD. Ce corpus de recherches expérimentales
sur
la
domestication a fourni des informations cruciales sur la nature du SD parce qu'il a permis
d'identifier des modifications génétiques initiales qui se sont produites au
cours de la domestication
de
nombreuses races,
modifications qui se sont produites il y a des siècles ou des millénaires, et de
nombreuses
modifications génétiques ultérieures (et plus spécifiques)
issues de
tentatives de sélection
postérieures (p. ex. pour la viande, les œufs, la laine, etc.).
La 2e explication de Darwin était que les
caractéristiques associées
à la
domestication découlaient de
l'hybridation de différentes races, voire d'espèces apparentées.
Effectivement, l'hybridation peut créer de nouvelles propriétés, mais
cette hypothèse n'explique pas pourquoi seuls les traits caractéristiques
spécifiques au SD, et
seulement
eux,
sont observés
chez de multiples espèces. En outre, on a testé expérimentalement
l'hypothèse de l'hybridation et
elle a réfutée comme explication globale chez plusieurs espèces : on a
répété le processus
de domestication essentiellement à partir de géniteurs issus de lignées
sauvages uniques, non
hybrides, et on a quand même obtenu le SD. Ce corpus de recherches expérimentales
sur
la
domestication a fourni des informations cruciales sur la nature du SD parce qu'il a permis
d'identifier des modifications génétiques initiales qui se sont produites au
cours de la domestication
de
nombreuses races,
modifications qui se sont produites il y a des siècles ou des millénaires, et de
nombreuses
modifications génétiques ultérieures (et plus spécifiques)
issues de
tentatives de sélection
postérieures (p. ex. pour la viande, les œufs, la laine, etc.).

Le premier corpus d'études expérimentales sur la domestication concernait des rats mais le plus exhaustif concerne des renards (Vulpes vulpes). Il faisait partie d'un projet de recherche majeur lancé en 1959 par Dimitri K. Belyaev, à Novossibirsk, continué ensuite sous la direction de Ludmila Trut et arrêté en 2018, faute de moyens. Ce protocole expérimental de domestication comprenait un programme d'élevage sélectif à partir de renards vraimment sauvages, issus de fermes à fourrure, où aucune tentative de domestication n'avait été faite. Le protocole comprenait un programme d'élevage sélectif intensif visant uniquement à accroître le degré de docilité et d'apprivoisement des générations successives, en sélectionnant à chaque fois les renardeaux les plus soumis et en ne faisant ensuite reproduire que ceux-là. À chaque génération, les renards ont été méthodiquement examinés pour déceler des changements comportementaux ou morphologiques. Après plus de 50 ans d'élevage sélectif, ce programme a montré que l'ensemble des caractéristiques constituant le SD peut apparaître assez rapidement, avec l'apprivoisement pour seul critère sélectif, dans une espèce sans antécédents de domestication. Le même groupe de recherche a obtenu des résultats analogues chez le rat et le vison, avec le même protocole de sélection. Ces travaux ont établi que le SD est vraiment un ensemble de caractéristiques qui se développent en coïncidence partielle et non un assemblage de caractéristiques acquises indépendamment les unes des autres ou successivement.
Suite à la suggestion de Darwin selon laquelle l'origine des modifications chez les animaux domestiques était les « conditions de vie » plus faciles assurées par la domestication, Belyaev a soutenu que la réduction du niveau de stress des animaux vivant dans un environnement humain protégé provoque de multiples modifications des réponses hormonales, qui reconfigurent les modèles d'expression des gènes. Il a suggéré que les modifications initiales étaient épigénétiques mais qu'avec le temps, elles deviendraient héréditaires. Plus récemment, Trut et al., en 2004, ont proposé qu'un seul réseau de régulation génétique (GRN) sous-tend les caractéristiques du SD, et que le syndrome résulte d'altérations de régulateurs assez « en amont », ce qui entraîne la dysrégulation de modules génétiques en aval impliqués dans le développement des différents types de tissus affectés par le SD. Ces modifications des régulateurs en amont pourraient être soit des épimutations stables (transmissibles par la lignée germinale), soit de véritables mutations (génétiques). En principe, cette explication peut englober la diversité des traits caractéristiques exprimée dans le SD.
Cette dernière hypothèse pose toutefois 2 problèmes :
 Le 1er
est
le
domaine phénotypique
élargi du GRN supposé, qui en fait le plus étendu de tous ceux qui ont
été précédemment décrits. Les
GRN actuellement connus sont spécialisés dans le contrôle de processus plus
simples ou plus réduits,
comme la délimitation de régions précises de l'embryon à un stade
précoce ou le développement de structures particulières, comme
les
ailes des
insectes ou le pancréas des mammifères.
Le 1er
est
le
domaine phénotypique
élargi du GRN supposé, qui en fait le plus étendu de tous ceux qui ont
été précédemment décrits. Les
GRN actuellement connus sont spécialisés dans le contrôle de processus plus
simples ou plus réduits,
comme la délimitation de régions précises de l'embryon à un stade
précoce ou le développement de structures particulières, comme
les
ailes des
insectes ou le pancréas des mammifères.
 Le 2e problème est qu'elle postule
l'existence, en amont du
réseau
supposé, de
mutations (ou épimutations) aux effets spectaculaires, très étendus,
mais non létaux. Le constat d'un taux de mortalité
prénatale plus élevé chez les renards domestiqués que chez les
animaux témoins de la ferme d'élevage indique des effets nocifs
modérés,
c'est-à-dire d'une ampleur inférieure à
celle attendue de mutations invalidantes dans un grand réseau GRN à action
précoce. Cette explication qui postule un réseau unique contrôlant
directement tous les
caractéristiques affectées par le SD, pose donc problème.
Le 2e problème est qu'elle postule
l'existence, en amont du
réseau
supposé, de
mutations (ou épimutations) aux effets spectaculaires, très étendus,
mais non létaux. Le constat d'un taux de mortalité
prénatale plus élevé chez les renards domestiqués que chez les
animaux témoins de la ferme d'élevage indique des effets nocifs
modérés,
c'est-à-dire d'une ampleur inférieure à
celle attendue de mutations invalidantes dans un grand réseau GRN à action
précoce. Cette explication qui postule un réseau unique contrôlant
directement tous les
caractéristiques affectées par le SD, pose donc problème.

Toutes les diverses caractéristiques du SD ont
en commun un développement étroitement lié aux cellules de la crête
neurale (CCN). Les CCN sont une
classe de cellules souches spécifiques aux vertébrés, qui apparaissent
tôt pendant l'embryogenèse
dans la région la plus dorsale (« crête ») du tube neural, puis
migrent
ventralement à travers
tout le corps vers le crâne et le tronc. Elles donnent alors naissance aux
précurseurs
cellulaires
de nombreux types de cellules et de tissus et favorisent indirectement le développement
des
autres. Les tissus dérivés des
CCN
incluent une
grande partie des précurseurs du crâne, des ganglions sympathiques, de la
médullosurrénale, des
mélanoblastes précurseurs de la pigmentation de la tête et du tronc, et les
précurseurs dentaires
(odontoblastes). En ce qui concerne spécifiquement la tête, les cellules de
la
crête neurale
céphalique (CCNC) sont des précurseurs essentiels des composants osseux,
cartilagineux
et nerveux de
la région cranio-faciale, y compris les mâchoires, l'os hyoïde, le
larynx, et
les
oreilles externes
et moyennes. Bien que les CCN ne soient pas des précurseurs directs du système
nerveux
central ou du cortex surrénal, elles jouent un rôle important dans le
développement
de
ces tissus via des
interactions embryologiques post-migratoires.
Les auteurs postulent que les multiples modifications qui caractérisent le SD reflètent une réduction de l'apport des cellules de la crête neurale pendant la croissance pour tous les traits concernés. Pour eux, si la cause du développement du SD est unique, les modifications génétiques qui sous-tendent l'affaiblissement de la crête neurale sont diverses et elles impliquent de multiples changements génétiques à effet quantitatif modéré.
En résumé, ils suggèrent que la sélection initiale en vue de l'apprivoisement cause la réduction des tissus dérivés de la crête neurale qui déterminent le comportement, via de multiples variantes génétiques préexistantes qui affectent le nombre de CCN sur leurs sites finaux, et que cette hypofonction de la crête neurale produit, comme effet dérivé, les modifications morphologiques de la pigmentation, des mâchoires, des dents, des oreilles, etc. exprimés par le SD. Le déficit en cellules de la crête neurale constaté en cas de SD pourrait se produire de 3 façons : la formation d'un nombre réduit de CCN initiales, la réduction des capacités migratoires des CCN et donc une quantité réduite de ces cellules sur les sites finaux, ou une prolifération moindre de ces cellules sur ces sites. Pour eux, les anomalies de migration sont vraisemblablement très importantes. De ce point de vue, les phénotypes caractéristiques du SD exprimés dans les parties du corps assez éloignées des sites d'origine des CCN, comme la face, les extrémités des membres, la queue et la ligne médiane du ventre, reflètent une probabilité plus faible que les CCN atteignent ces sites en quantité requise. La variabilité aléatoire interindividuelle de ces patrons pigmentaires est cohérente avec cette hypothèse.
On connaît de nombreux gènes qui jouent un rôle essentiel dans les caractéristiques de la crête neurale, la migration et les interactions post-migratoires. Étant donné l'importance biologique des tissus dérivés des CCN, il n'est pas surprenant que l'inactivation de ces gènes soit souvent mortelle en cas d'homozygotie, et souvent gravement débilitante même chez les hétérozygotes. Ces affections, connues depuis longtemps, portent le nom générique de « neurocristopathies ». Par contre, aucune preuve génétique n'indique que les changements observés chez les animaux domestiqués résultent de mutations d'un gène qui serait spécifique de « la domestication ». Les changements phénotypiques observés chez les espèces domestiques sont plutôt quantitatifs, non pathologiques et principalement d'importance modérée. Ainsi, les analyses de loci de caractères quantitatifs (LCQ) comparant expérimentalement des rats et des renards domestiqués et leurs ancêtres sauvages respectifs impliquent généralement de nombreux allèles à effet modéré tout comme les récentes comparaisons génétiques entre le chien et le loup. Enfin, des études expérimentales de domestication montrent que les réponses des populations à fondateur de souche sauvage à la sélection en vue de l'apprivoisement sont très rapides, même en cas de croisements éloignés. Cela suggère fortement que de multiples allèles existants contribuent à la réponse à la sélection, plutôt que de nouvelles mutations ou l'accumulation d'allèles récessifs qui leur confèreraient une homozygotie. Une cause génétique polygénique sous-jacente, qui impliquerait de multiples allèles à effet individuel assez faible dans de nombreux gènes différents, causerait l'hypofonction des CCN.

Les modifications de la pigmentation par rapport au type sauvage sont un des changements les plus frappants et les plus constants au cours de la domestication. Le pelage de toutes les races d'animaux domestiques présente des zones de relative dépigmentation, souvent sous forme de taches ou de zones blanches, parfois de taches brunes. Les modifications de la pigmentation sont un des premiers traits caractéristiques à apparaître lors de la domestication des renards, des visons (Mustela vison) et des rats (Rattus norvegicus) sélectionnés pour leur apprivoisement. Chez ces animaux, les zones dépigmentées sont généralement constituées de taches blanches irrégulières observées à certains endroits : juste sous la gorge et au-dessus des yeux, sur les pattes et à l'extrémité de la queue. On pense ici à la connexion avec les cellules de la crête neurale, car ces zones blanches manquent généralement de mélanocytes, et les mélanocytes dérivent des CCN. Les cellules pigmentaires des vertébrés dérivant de la crête neurale, ces modifications de la pigmentation sont clairement cohérents avec notre hypothèse. Globalement, ce sont les zones du corps qui reçoivent une migration retardée des CCN qui sont susceptibles d'être dépigmentées.
Les effets de la pigmentation sont assez bien connus. On sait qu'au moins 125 gènes affectent la pigmentation d'une manière ou d'une autre, dont au moins 25 impliquent la croissance et la migration de la crête neurale. La base génétique des modifications de la pigmentation est complexe, avec d'importants effets pléiotropes et épistatiques.
Les auteurs considèrent que leur hypothèse est étayée par le tableau clinique variable associé au syndrome de Waardenburg. La maladie de Waardenburg est une maladie génétique assez courante mais à expression très variable, dont les variantes les plus courantes résultent de mutations du gène Pax3. Le syndrome de Waardenburg se subdivise en 4 types, mais les effets globaux comprennent des signes primaires (surdité et modifications de la pigmentation, en particulier une mèche de cheveux blancs) et de nombreux autres symptômes plus variables, y compris des taches de peau blanche, une dysmorphie crânienne, des yeux très pâles et une absence de système nerveux entérique (maladie de Hirschsprung). Tous ces symptômes variables indiquent une interruption du développement liée aux CCN. Les mélanocytes dérivés de la crête neurale fournissent un apport indispensable à l'oreille interne, sans lequel se produit une surdité. Les ganglions et les neurones du système nerveux entérique, comme le système nerveux sympathique, sont aussi dérivés de la crête neurale. Les symptômes variables du syndrome de Waardenburg sont donc cohérents avec notre hypothèse et révélateurs de la nature complexe et épistatique des gènes qui influencent la crête neurale.
Tant de facteurs génétiques et de croissance interagissent dans le processus de pigmentation qu'il n'est pas surprenant que les anomalies de pigmentation, même celles dérivées de mutations dans un seul gène, présentent une grande variabilité interindividuelle ou liée à une mutation spécifique. P. ex., des mutations bien étudiées chez la souris peuvent causer un albinisme intégral, des taches blanches, des pattes blanches ou une large bande blanche, selon le contexte génétique et la mutation précise. Les déficits en pigmentation des souris mutantes et des espèces domestiquées tendent à être plus visibles quand ils sont plus éloignés du site d'origine de la crête neurale, comme les pattes ou la ligne médiane du ventre.
Une 2e caractéristique des mammifères domestiqués est la réduction des mâchoires supérieure et inférieure et du squelette facial autour d'elles (le « museau ») par rapport aux ancêtres de type sauvage (on at sélectionné à titre secondaire des mâchoires plus courtes chez certaines races de chiens, mais elles ne dépendent pas directement du SD, qui concerne toutes les races et espèces). De plus, pendant la domestication expérimentale de renards et de visons par le Groupe de Novossibirsk, la réduction de la taille du museau et de la mâchoire a accompagné précocement et globalement la sélection pour la docilité. La taille réduite du museau est corrélée à des faces plus rondes et plus plates, observées chez les deux espèces.
Chez les mammifères, les mâchoires supérieure et inférieure et le squelette facial qui les entoure (museau) sont issus de 2 paires de bourgeons faciaux, le processus maxillaire (source primaire de la mâchoire supérieure) et le processus mandibulaire (qui produit la mâchoire inférieure), ainsi que des processus nasaux latéral et médian. Les 2 composants des mâchoires se développent après la migration des CCNC vers les sites initiaux. La taille des mâchoires dépend de la quantité d'apports en CCN : des mâchoires plus petites reflètent des quantités de CCN plus faibles car la réduction importante de leur nombre dans les bourgeons faciaux restreint considérablement le développement de la partie inférieure de la face, y compris des mâchoires.
Le syndrome de Treacher Collins est un syndrome clinique humain bien connu. L'un de ses principaux symptômes est la réduction de la taille de la mâchoire (micrognathie) et des os zygomatiques (hypoplasie faciale). D'autres aspects significatifs de ce syndrome incluent des anomalies dentaires (agénésie ou malformations des dents dans 60 % des cas), la malformation des cartilages externes des oreilles (les oreilles peuvent être absentes, de taille réduite ou malformées) et une surdité de transmission causée par la taille réduite ou l'absence des os de l'oreille moyenne (dérivés de la crête neurale). Dans 80 à 90 % des cas, Treacher Collins est causé par des mutations du gène TCOF1, qui code pour la protéine Treacle, impliquée dans la production des ribosomes normaux. Comme généralement pour les neurocristopathies, les malades de Treacher Collins survivants sont hétérozygotes, et la maladie est due à une haplo-insuffisance. L'haplo-insuffisance du gène TCOF1 cause spécifiquement une baisse des niveaux de Treacle, qui à son tour cause l'épuisement des précurseurs des CCN des premier et deuxième arcs viscéraux.
Le syndrome de Mowat-Wilson, une autre neurocristopathie humaine, est un syndrome rare caractérisé par une microcéphalie, un rétrécissement caractéristique de la mâchoire et de nombreux autres symptômes liés à la crête neurale (p. ex. des modifications de la morphologie de l'oreille, une cardiopathie, et, comme pour Waardenburg, une éventuelle présence de la maladie de Hirschsprung) avec un retard mental et de l'épilepsie. Les patients atteints de ce syndrome « ont un comportement joyeux et sourient fréquemment », ce qui correspond aux modifications du comportement observés pendant la domestication des animaux. La base génétique de Mowat-Wilson est claire : elle implique principalement des mutations du gène ZEB2 causant l'absence du signal de délamination des cellules de la crête neurale du tube neural.
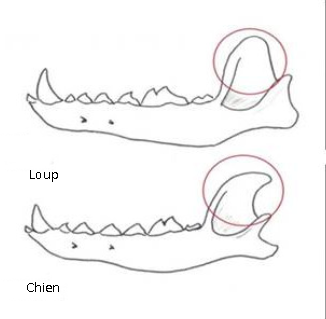
La réduction de la taille des dents par rapport aux ancêtres de type sauvage est un autre changement typique associé à la domestication chez les mammifères. Cela concorde aussi avec l'hypothèse, car les cellules de la crête neurale sont directement impliquées dans le développement des dents. La majeure partie de chaque dent se développe à partir d'odontoblastes dérivés des CCN. Les couronnes d'émail sont produites à partir des améloblastes, qu'on ne considère traditionnellement pas comme dérivés des CCNC, mais des données récentes suggèrent ici aussi une contribution de la crête neurale. En théorie, on s'attend donc à une réduction de la taille des dents en cas de diminution du nombre de CCNC. Cette prédiction est confirmée en pratique par la réduction de la taille des dents ou leur absence, courantes en cas de syndrome de Treacher Collins, mentionné ci-dessus.

Les oreilles souples sont un élément du SD que l'on observe chez une ou plusieurs races de presque toutes les espèces domestiquées, alors que les seuls mammifères sauvages aux oreilles souples sont les éléphants. Ce caractère peut être compris en considérant les sources de la croissance de l'oreille externe : le pavillon des mammifères se développe à partir d'une convergence de tissus de l'ectoderme, du mésoderme et de l'endoderme, et de CCNC dérivées du cerveau postérieur. Le cartilage et les tissus conjonctifs du pavillon de l'oreille dérivent de cellules dérivées des CCN des 1er et 2e arcs branchiaux, mais les segments des CCN à l'origine du cartilage et des tissus conjonctifs ne sont pas forcément les mêmes. On peut donc expliquer le phénotype de l'oreille souple comme la conséquence d'un léger déficit en cartilage dérivé des CCN, qui produit un pavillon insuffisamment rigide par rapport à la quantité nécessaire au phénotype de l'oreille érigée.
Cette explication théorique est confirmée en pratique par la réduction de la taille des oreilles ou leur absence observées dans les neurocristopathies mentionnées ci-dessus. En effet, les syndromes de Treacher Collins et de Mowat-Wilson sont tous 2 caractérisés par des oreilles absentes, de taille réduite ou malformées. Bien sûr, on doit noter que les petites oreilles externes des humains et des rongeurs fournissent des modèles imparfaits pour les oreilles allongées et droites de la plupart des carnivores et des artiodactyles. Cependant, la polychondrite atrophiante, une maladie auto-immune qui attaque notamment les collagènes de l'oreille externe, peut causer des oreilles souples « tombantes » même chez l'homme, ce qui étaye l'hypothèse d'un lien entre le manque de cartilage et les oreilles souples.
En clair, les auteurs expliquent que les principaux composants morphologiques du SD peuvent tous être expliqués par la dérivation des tissus concernés à partir de la crête neurale. Pour eux, des anomalies de la formation de la crête neurale au début de la croissance causent une réduction des populations de mélanocytes (ce qui infère des modifications
Les carences en pigmentation peuvent avoir des effets variés en fonction des allèles des autres gènes en interaction. Ces effets épistatiques, combinés à la pléiotropie de la plupart des gènes concernés par la crête neurale, signifient que les effets de la réduction de la crête neurale sont très variables d'une espèce à l'autre et au sein des espèces. Nous ne connaissons pas de mutation ou de syndrome clinique unique capable de reproduire tous les effets phénotypiques du SD et seulement eux, mais nous l'avions prévu car nous ne partons pas de l'hypothèse que le SD dérive de modifications dans un ou plusieurs gènes. Au contraire, les données ci-dessus étayent clairement la présence concomitante de multiples composants du SD comme effets combinés de multiples mutations affectant les CCN et, quand on les considère dans leur ensemble, tous les composants sont connus pour résulter d'effets génétiques liés aux CCN. Conjuguées aux données expérimentales sur la domestication, ces données étayent fortement une cause multigénique du SD, axée sur le développement de dérivés de la crête neurale.
La caractéristique comportementale la plus importante chez tous les animaux domestiques est la réduction de l'agressivité et l'augmentation de la docilité (« apprivoisement »), par rapport à leurs ancêtres de type sauvage. Les études expérimentales de domestication de renards, de rats et de visons montrent clairement que la sélection axée sur le seul apprivoisement, qui est un caractère comportemental, peut causer les multiples changements morphologiques corrélés du SD discutés ci-dessus. On peut relier la plupart de ces traits caractéristiques morphologiques à une dégradation de la fonction de la crête neurale. Mais comment, précisément, l'hypofonction de la crête neurale mène-t-elle à l'apprivoisement ? Il existe au moins 2 voies possibles, qui ne s'excluent pas mutuellement.
Le système nerveux sympathique, qui régit la réponse « combat ou fuite » aux stimuli nouveaux ou menaçants, est un composant bien étudié de l'apprivoisement. Ces réponses comportementales reposent essentiellement sur l'axe hypothalamo-hypophyso-surrénal (axe HHS), qui convertit rapidement l'information perceptive d'origine neuronale (« il y a quelque chose d'étrange ou menaçant ici ! ») en signaux hormonaux, notamment en épinéphrine (« adrénaline »), libérée par la médullosurrénale, dérivée des CCN. Cette poussée hormonale prépare à son tour le corps à une action puissante et rapide. Cette réaction rapide s'accompagne de réactions de stress plus lentes, causées principalement par le cortex surrénal via les hormones corticostéroïdes, qui entraînent une réactivité élevée à long terme. Les réponses au stress jouent un rôle puissant dans le SNC et affectent en retour le cerveau pour jouer un rôle dans le processus cognitif et l'apprentissage des situations menaçantes ou stressantes.
Le système gérant la peur et le stress semble être régulé à la baisse chez les mammifères domestiques. Il établit un lien manifeste entre l'apprivoisement et la crête neurale, via l'hypofonction surrénale et la réduction de la taille des glandes surrénales. Chez les renards et les rats domestiqués on a constaté que les glandes surrénales sont plus petites que chez leurs homologues non sélectionnés. Chez les renards domestiqués, les surrénales sont déjà significativement réduites in utero, et de multiples aspects de la fonction surrénale sont aussi régulés à la baisse, y compris les niveaux de base des hormones corticosurrénales et la réponse des cellules surrénales à l'adrénocorticotrophine, régulateur en amont de la libération de l'hormone du stress. Par conséquent, après 45 générations de sélection en vue de l'apprivoisement, les renards domestiqués ont montré une réduction substantielle des niveaux de cortisol induits par le stress dans le sang comme du cortisol basal. On a aussi réduit expérimentalement la taille des glandes surrénales et les taux de corticostérone sanguine chez des rats domestiqués. Des lois similaires semblent aussi s'appliquer aux oiseaux domestiques : les poulets domestiques sont moins craintifs et moins réactifs que le Coq sauvage, et les niveaux de cortisol basal sont aussi réduits chez les Capucins domino domestiques, en comparaison avec leurs ancêtres de type sauvage (élevés en captivité).
La domestication cause donc systématiquement une réduction de la réaction physiologique périphérique aux stimuli ou aux situations stressantes, ce qui a un effet direct et immédiat sur l'apprivoisement en réduisant la réactivité en cas de peur. Cependant, Belyaev a souligné un 2e effet moins direct, mais tout aussi important : l'effet sur la croissance de l'hypofonction du SNS chez les renards domestiques. Aussitôt après la naissance et pendant leur premier mois ½ de vie, l'axe HHS des renardeaux sauvages (non sélectionnés) est trop immature pour produire une réaction de stress et de peur totalement exprimée, même si les renardeaux se déplacent et explorent les yeux ouverts. À la fin de cette période, les renardeaux deviennent très réactifs et craignent les animaux étranges, y compris les humains. Les renards domestiqués subissent le même effet mais la durée d'immaturité de leur axe HHS est beaucoup plus longue, soit 3-4 mois. Les animaux domestiqués ont donc une plus longue « fenêtre de socialisation ». Dans des conditions normales d'élevage en captivité, les renardeaux domestiqués sont exposés à des interactions répétées avec les soigneurs humains avant que la réponse physiologique complète à la peur soit possible. L'exposition précoce à l'humain implique que, le temps que l'axe HHS arrive à maturité, les soigneurs sont perçus comme des stimuli faiblement menaçants : plus tard dans la vie, les humains n'initient donc pas le composant de réponse à la peur géré neuronalement (dans ce cas, la familiarité engendre l'indifférence).
On observe aussi des différences comparables entre les loups (dont la fenêtre de socialisation est de 1,5 mois), et les chiens (chez qui cette fenêtre s'étend de 4 à 10 mois), comme chez les souris de laboratoire sélectionnées pour leur faible niveau d'agressivité. Fondamentalement, même les chiens domestiqués deviennent craintifs et inapprivoisables à vie s'ils ne rencontrent pas d'humains au cours de cette fenêtre plus longue. Ainsi, un léger décalage hétérochronique de la réactivité sympathique, causé par un retard de maturation des glandes surrénales, peut avoir d'importants effets à des niveaux cognitifs supérieurs tout au long de la vie, via la simple prolongation d'une période sensible pour un contact positif avec l'homme.
La taille du cerveau de la plupart des animaux domestiques est nettement réduite par rapport à leurs ancêtres de type sauvage, mais à des degrés variables. Cette réduction, surtout importante dans le cerveau antérieur, est très forte chez certaines espèces. P. ex. le cerveau d'un porc domestique est 35% plus petit que celui d'un sanglier de même taille, son ancêtre sauvage présumé. Les réductions sont habituellement un peu moins fortes, p.ex. environ 20% chez les visons domestiqués et environ 16 % chez les chevaux. Cependant, même si ce modèle est quasi universel, il y a 2 exceptions : la réduction de la taille du cerveau est très limitée chez les renards domestiques (seulement 2 % par rapport à leurs ancêtres connus non apprivoisés) et aucune réduction n'est survenue pendant la domestication chez les souris de laboratoire. Néanmoins, les souris de laboratoire et les renards domestiqués étant très apprivoisés, la réduction de la taille du cerveau n'est manifestement pas en soi un déterminant crucial de l'apprivoisement. Plutôt que la réduction globale de la taille du cerveau, il semble plus probable que la réduction de composants particuliers du cerveau antérieur soit à l'origine des fonctions importantes du système nerveux central dans l'apprivoisement.
L'altération des fonctions reproductives est un autre composant du SD potentiellement lié à la réduction de la taille du cerveau. Les femelles de nombreuses espèces domestiquées ont des cycles œstraux plus fréquents et leur reproduction perd souvent son caractère strictement saisonnier. Cela implique sans doute l'axe hypothalamo-pituito-gonadique (HPG), qui régit les cycles de reproduction des mammifères. Les effets de l'axe HPG sur l'appareil reproducteur des femelles étant essentiellement inhibiteurs, on s'attend à ce qu'un fonctionnement réduit de l'axe HPG produise les traits associés au SD, soit une maturation reproductive accélérée et des intervalles réduits entre les naissances. Cela peut aussi être dû à la glande pinéale, un dérivé de la plaque neurale dont on ne pensait pas qu'il était dérivé des CCN. La glande pinéale joue un rôle crucial dans la périodicité des cycles d'œstrus en fonction de la longueur du jour. Elle est plus petite chez la femelle du renard domestique que chez celle du renard sauvage, et produit des niveaux de mélatonine inférieurs.
Selon des études récentes, la réduction de la taille du cerveau pourrait aussi résulter de la réduction du nombre des cellules de la crête neurale céphalique. Ces cellules ne sont les progéniteurs directs d'aucune partie du cerveau, y compris le système limbique, mais elles jouent un rôle indirect essentiel dans le développement du cerveau antérieur.
Jusqu'à présent, on n'a trouvé aucune mutation monogénique qui reproduise le phénotype du SD dans son ensemble. Vu la relative facilité de sélection de ce syndrome ce n'est pas surprenant, car le taux de mutation spontanée des gènes uniques est sans doute trop faible pour que la réponse à la sélection soit efficace. On peut donc supposer que le SD est polygénique. De plus, il ne nécessite probablement pas l'homozygotie des allèles récessifs : le Groupe de Novossibirsk a produit le SD chez des animaux sélectionnés par outcrossing, en utilisant des animaux issus de diverses populations de renards, réduisant ainsi l'homozygotie. L'inférence la plus simple est donc que le SD découle d'une variation génétique préexistante composée de mutations à petits effets semi-dominants dans des gènes plus ou moins nombreux. Le SD a été produit chez tant d'espèces de mammifères que cette variation préexistante pourrait être fréquente. On peut expliquer cette omniprésence par le fait que ces allèles confèrent une sorte d'avantage hétérozygote. Une autre explication serait que des mutations peuvent avoir un effet quasi-neutre individuellement, mais que lorsqu'elles combinées de diverses façons, elles produisent le spectaculaire phénotype du SD. La récente étude qui montre que le phénotype balzan chez les chevaux, caractérisé par de grandes taches blanches, a une base multigénique similaire peut fournir un exemple pertinent d'une telle synergie polygénique. Cette étude montre aussi qu'il n'est pas nécessaire que toutes les variations héréditaires requises pour produire le phénotype soient préexistantes : une nouvelle mutation a contribué à sa formation dans l'une des lignées de chevaux.
Pour les auteurs, ces caractéristiques génétiques générales du SD concordent avec leur hypothèse selon laquelle les gènes de la crête neurale sont spécifiquement la source par excellence du SD, notamment parce que le SD implique de multiples mutations par perte de fonction bénignes dans plusieurs des gènes concerné.

Cependant, les mutations ponctuelles classiques ne sont pas forcément la seule origine génétique du syndrome : les altérations générées par recombinaison d'éléments répétitifs particuliers sont corrélées aux changements morphologiques chez les carnivores et pourraient être aussi impliquées ici. Il est possible que certains éléments non codants conservés (CNE) soient des éléments répétés et que les CNE soient associés à divers gènes de la crête neurale liés à des neurocristopathies connues. Les modifications d'éléments répétés générées par recombinaison peuvent se produire à des taux bien plus importants que les mutations ponctuelles. Il est possible que que certains changements initiaux soient des changements épigénétiques et non des altérations de séquence d'ADN. En particulier, le groupe de Novossibirsk soutient depuis longtemps que l'état hormonal de la mère, associé aux conditions de vie moins stressantes des animaux domestiques, contribuent à la formation du SD. Ces épimutations auraient la stabilité nécessaire au cours de la transmission transgénérationnelle pour générer de véritables états héréditaires. En ce qui concerne le SD, la preuve la plus convaincante de l'implication d'effets épigénétiques concerne le gène « Star » chez le renard, proposé par Belyaev comme cause de l'apparition initiale d'une tache frontale blanche au début du développement du SD. Star a un taux de modifications héréditaires trop élevé pour une mutation conventionnelle. Il est aussi possible que des épimutations quasi-stables se transforment en véritables mutations génétiques.
Dernier point : chez différentes espèces domestiquées, les 3 mécanismes (mutations ponctuelles, recombinaison d'éléments répétés et épimutations) pourraient être impliqués mais combinés de diverses façons et dans des gènes différents. Quand les loci impliqués dans le SD auront été identifiés, on devrait pouvoir dire quels mécanismes concernent des gènes particuliers dans des races précises.
L'hypothèse soulève bien sûr d'autres questions sur la biologie de la croissance, la neurobiologie et la génétique. La relation exacte entre la docilité, objectif initial présumée de la sélection humaine, et son lien avec les changements supposés dans le développement neuronal, est une question de neurobiologie du développement particulièrement cruciale. Outre les facteurs évoqués plus haut, il est possible qu'en cas de sélection, la docilité résulte en partie d'un ralentissement du développement neuronal, qui causerait à son tour une réaction émotionnelle relativement immature à la menace sociale, en particulier une réponse faible à la peur, impliquant une série d'événements qui, dans ce cas, serait initiée par une neurocristopathie modérée. Même s'il existe certainement d'autres voies vers la docilité, la cible génétique relativement large pour les affections neurocristopathiques partielles ou modérées, étant donné le grand nombre de gènes impliqués et nécessaires à la biologie de la crête neurale, pourrait en faire une direction privilégiée.
Les auteurs soulignent que de nombreuses lacunes et incertitudes subsistent et qu'il faut mieux élucider les bases génétiques et épigénétiques précises du syndrome de domestication. Les questions génétiques primordiales concernent les gènes spécifiques dont les formes mutantes sont impliquées dans l'apparition du SD. Les déterminer requerra une analyse génétique détaillée de ce syndrome et, de préférence, chez plusieurs espèces, car des gènes multiples et divers des cellules de la crête neurale peuvent être impliqués.
Crédit photos :
Merci aux participants du groupe CoonCept sur Face Book et :Sources supplémentaires :