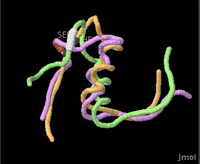Prévalence de la mutation de la protéine C de liaison à la myosine chez le Maine Coon
D'après R. Fries, A.M. Heaney, et K.M. Meurs ; article publié en février 2008 dans le Veterinary Journal of Internal Medicine.
En 2005, une mutation autosomique dominante [1] a été identifiée dans le gène de la protéine C de liaison à la myosine ou MYBPC3 des Maine Coons. Cette mutation substitue un aminoacide Les aminoacides ou acides aminés sont les molécules unités qui constituent une protéine. Il en existe 20 différents.à un autre et, dans les modèles informatiques [2], modifie la structure spatiale de la protéine codée par ce gène chez les Maine Coons atteints de cardiomyopathie hypertrophique.
L'objectif de l'étude que nous résumons ici était de déterminer la prévalence génétique de la mutation MYBPC3 chez une grande quantité de chats pour la plupart des Maine Coons. Trois mille trois cent dix échantillons ADN (sang ou cellules buccales) de chats ont été analysés par le Laboratoire Vétérinaire de Génétique Cardiaque à l'Université de l'Etat de Washington.
La cardiomyopathie hypertrophique ou HCM est la maladie cardiaque la plus répandue chez le chat. Chez le Maine Coon, elle est héritée comme un caractère autosomique dominant. Elle se caractérise par une hypertrophie modérée à sévère du muscle papillaire et du ventricule gauche et, en histopathologie, par une désorganisation des fibres du myocarde. L'épaisseur accrue de la paroi et la fibrose du myocarde causent un accroissement de la raideur de la chambre ventriculaire gauche et diminuent le volume diastolique de l'extrémité du ventricule gauche. Ces changements ont pour résultat une augmentation de la pression diastolique ventriculaire gauche et de la pression dans l'oreillette gauche, ce qui mène à un arrêt cardiaque congestif.
L'objectif de l'étude:
La détermination de la prévalence génétique et de la distribution de la mutation MYBPC3 à partir d'un échantillon de 3310 chats de races diverses.Un unique changement de base (la guanine est remplacée par la cytosine) dans l'exon 3 Les exons sont les portions de la séquence du gène qui sont codantes. Les portions non codantes sont les introns. du gène [1] de la protéine C de liaison à la myosine a été identifié chez certains Maine Coons atteints de HCM.
Chez l'humain, on estime la prévalence de la HCM dans la population à 0,2%, les mutations du gène MYBPC3 représentant 14 à 26% des patients qui présentent une HCM clinique. La prévalence de cette maladie chez le chat est mal définie ; elle a été estimée à 1,6%, 5,2%, 6,9%, et 8,3%, selon les études. Ces variations s'expliquent par la population choisie et la méthode de diagnostic. La prévalence de la maladie dans la population de Maine Coons n'est pas connue, mais un dépistage a permis la détermination du pourcentage mondial de chats affectés par la mutation du gène MYBPC3. L'objectif de cette étude était d'établir la prévalence et la distribution de la mutation MYBPC3 pour la HCM dans les échantillons d'ADN félin envoyés pour évaluation.
Les échantillons ont été envoyés au Laboratoire Vétérinaire de Génétique Cardiaque de l'Université de Washington entre décembre 2005 et Février 2007. La partie du gène félin MYBPC3 a été amplifiée par PCR [3] pour détermination du statut. Ces échantillons ont été envoyés par des propriétaires de chats volontaires. Ils provenaient de chats cliniquement normaux et de chats qui présentaient des signes de HCM clinique, dépistée à l'échographie. Dans la plupart des cas, le statut phénotypique du chat était inconnu lors de l'analyse de l'ADN.
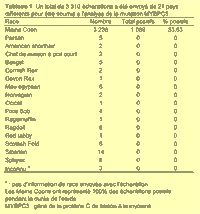
Au total 3 310 échantillons ont été envoyés de 21 pays différents. Ils comprennent des échantillons d'au moins 17 races (voir le tableau 1). Les Maine Coons représentaient 100% des échantillons positifs. Lors de cette étude, aucune autre race n'a été testée positive pour la mutation MYBPC3.
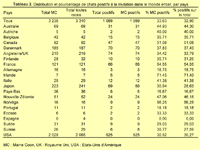
2 065 échantillons provenaient des Etats-Unis, 241 du Japon, 219 d'Angleterre, 187 du Danemark, 121 de France. 16 autres pays totalisaient 477 échantillons (tableau 2). Quatre continents étaient représentés : l'Amérique du Nord (2 120 échantillons), l'Europe (775), l'Asie (223) et l'Australie (121).
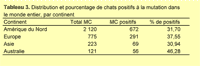
Le pourcentage de Maine Coons qui présentaient au moins 1 copie de la mutation pour chaque situation géographique étaient pour l'Amérique du Nord 31,7% (672/ 210), pour l'Europe 37,6% (291/7575), pour l'Asie 30,9% (69/223) et pour l'Australie 46,3% (56/121) (tableau 3).
Les résultats:
Seuls des Maine Coons ont été testés positifs (aucune autre race n'était affectée par la mutation). Sur 100% des Maine Coons testés positifs, 90,7% étaient hétérozygotes, les autres homozygotes. Le pourcentage moyen de Coons présentant la mutation est de 34% pour le monde entier.Le pourcentage moyen de Maine Coons présentant la mutation était de 34% pour le monde entier (tableau 2).
Sur 1 089 Maine Coons positifs, 988 (90,7%) étaient hétérozygotes Sujet qui, pour les 2 gènes MYBPC3 qu'il a, en possède un qui est muté. pour la mutation. Seuls 101 Maine Coons étaient homozygotes Sujet qui, pour les 2 gènes MYBPC3 qu'il a, possède les 2 versions mutées. pour la mutation, ce qui représente 3,1% du total des échantillons d'ADN de Maine Coons.
Dans la population humaine, la HCM est une maladie du sarcomère Le sarcomère est l'unité contractile du muscle dans laquelle l'actine coulisse sur la myosine..
Elle est causée le plus communément par une mutation différente des 8 gènes encodeurs de protéines qui constituent l'unité contractile cardiaque (plus de 400 de ces mutations sont recensées chez l'homme). Bien que l'on puisse considérer que la population féline ait une répartition de mutations génétiques similaire, la mutation du gène MYBPC3 semble spécifique au Maine Coon et être assez répandue dans cette population.
Un premier lien.
Et un autre…
Des 3 310 chats testés dans cette étude, 72 étaient de race non Maine Coon et tous ces chats étaient négatifs au test pour la mutation MYBPC3 (voir le tableau 1). Depuis que ces données ont été collectées, le Laboratoire Vétérinaire de Génétique Cardiaque a eu un test positif à cette mutation pour un Ragdoll et un pour un Sibérien. Ce résultat pourrait suggérer que ces chats ont un Maine Coon dans leurs ascendants. Cependant, récemment, une nouvelle mutation MYBPC3 a été identifiée chez le Ragdoll. Cette mutation se produit à un endroit différent de celle du Maine Coon. L'identification de deux mutations différentes sur ce gène chez des races sans lien laisse à penser que ces mutations se sont produites indépendamment, plutôt qu'elles aient été transmises par un fondateur commun. On a aussi observé une HCM familiale chez des American Shorthair et dans une portée de chats croisés qui ont été répertoriés avant la découverte de la mutation du Maine Coon et n'ont pas été testés pour elle.
Le biais de l'envoi des échantillons limite clairement l'interprétation de ces données. Certains éleveurs ont pu envoyer des échantillons de chats sans antécédent familial de HCM connu afin de pouvoir faire savoir que leurs lignées étaient négatives pour la mutation. D'autres ont pu envoyer des échantillons provenant de chats présentant des symptômes de HCM ou avec une HCM déclarée, afin de pouvoir utiliser les tests comme outils de sélection. Les chiffres présentés ici peuvent donc sous ou surévaluer le pourcentage de Maine Coons porteurs de la mutation. Cependant, au vu de la cohérence des résultats sur le plan mondial, la sélection de cas semble avoir résulté en une population très similaire envoyée de chaque pays. Globalement, ce pourcentage représente probablement plus précisément la population de Maine Coons d'élevage (soit des chats de moins de 5 ans, asymptomatiques à une HCM clinique).
Bien que l'information concernant le génotype puisse être utile aux éleveurs et aux propriétaires consciencieux qui essaient d'identifier les animaux à risque, rien ne nous permet aujourd'hui d'établir une relation génotype-phénotype. Les corrélations génotype-phénotype chez les humains indiquent que, pour certains gènes, il y a une forte corrélation entre l'emplacement de la mutation, la gravité de l'hypertrophie ventriculaire et l'incidence de la mort soudaine. En particulier, la HCM attribuable aux mutations du gène de la protéine C de liaison à la myosine a été associée plus communément à une hypertrophie modérée à faible pénétrance et à une incidence faible de décès soudain dû à un problème cardiaque. La mutation MYBPC3 chez le Maine Coon indique une expression clinique de la maladie qui varie suivant le génotype. Dans cette étude, un plus grand nombre de chats homozygotes pour la mutation a développé une maladie de modérée à grave, et la plupart sont morts de leur maladie à 4 ans ou moins, alors que 3 des 10 Maine Coons hétérozygotes pour la mutation étaient toujours en vie à 8-12 ans, avec une cardiopathie modérée. Chez les humains, certains individus au génotype HCM ne développent jamais de HCM clinique. Une situation semblable peut aussi exister chez les chats, et tous les chats positifs à la mutation MYBPC3 ne déclarent pas une HCM. Dans cette étude, nous n'avons pas essayé de corréler les informations concernant le génotype et celles sur le phénotype des échantillons envoyés. Certains propriétaires fournissent des informations sur l'état de santé cardiovasculaire du chat quand ils envoient les échantillons pour analyse, mais les informations sont très variables selon l'âge auquel l'examen cardiovasculaire a été effectué et comment il a été effectué.
Chez de nombreux chats, la HCM est initialement diagnostiquée après l'identification d'un souffle au cœur ou d'une tachycardie, et le chat reste indemne de signes cliniques pendant de nombreuses années. L'âge moyen au diagnostic de la HCM chez le chat est de 5,9 ans. En finale, les tests génétiques fournissent une opportunité de détecter les chats porteurs d'une mutation des années avant qu'ils ne développent une HCM clinique.
Conclusion
Les études chez les humains ont identifié des centaines de variantes génétiques qui débouchent sur une HCM clinique; cependant notre étude ne se focalise que sur l'une d'elles. On doit développer d'autres tests génétiques afin de dépister d'autres mutations potentielles chez le Maine Coon comme chez les autres races. Actuellement, une seule mutation est absolument identifiée comme cause de HCM chez le Maine Coon. Environ 34% des Maine Coons testés portent la mutation MYBPC3, et 90% de ces chats sont hétérozygotes pour le gène. Les données n'indiquent pas le pourcentage de chats affectés génétiquement qui développeront la maladie, comme elles n'indiquent pas le pourcentage de chats non affectés génétiquement qui développeront la maladie.
Les conclusions:
Le taux de 34% peut être admis comme la prévalence génétique déterminée par cette étude pour cette mutation .Il est très similaire pour tous les pays d'où provenaient les échantillons.
La prévalence de la maladie ne peut pas en être déduite.
L'échographie cardiaque seule permet le diagnostic de la HCM.
Les chats positifs étant considérés comme plus susceptibles de développer la maladie que les chats négatifs (ceci est fondé sur une publication précédente qui lie cette mutation à une réduction de la production de protéine et à une altération de la conformation de la protéine en simulation informatique), un vétérinaire cardiologue devrait périodiquement évaluer les chats positifs. En fin de compte, le test génétique est bénéfique pour identifier les chats affectés et ceux qui présentent un risque accru de développer une HCM clinique, et il est très profitable dans une perspective d'élevage, mais l'échographie cardiaque est nécessaire pour diagnostiquer la HCM.
La prévalence de la mutation (à l'état hétérozygote ou homozygote) était très similaire parmi les pays d'origine des envois, ce qui laisse à penser que le taux de mutation de 34% des échantillons testés est une estimation raisonnable de la prévalence réelle de la mutation dans la race. A cause de la forte prévalence de cette mutation, une recommandation d'élevage préconisant d'éliminer tous les chats porteurs de la mutation pourrait avoir un impact substantiel sur le patrimoine génétique. Des études complémentaires sont indiquées pour explorer les relations entre le génotype et l'expression clinique chez les chats touchés.
Commentaires de Pascal Ramassamy, Docteur vétérinaire
L'étude permet de révéler la mutation d'un gène codant la protéine induisant la maladie, mais la modification (interne) de ce gène donc du génotype, ne permet pas d'évaluer le risque d'apparition de la maladie. N'oublions pas que dans le cas du chat les recherches ne s'arrêtent encore qu'au stade d'un gène (or en humaine nous savons que 8 gènes codent des protéines constituant le muscle cardiaque).Sommes-nous certains que la modification de la protéine C induit la pathologie cardiaque qui réellement conduit à la mort de l'animal ?
Le mot d'Odile
Très peu de maladies génétiques sont monogéniques, c'est-à-dire consécutives à une mutation pathogène d'un seul gène. La plupart sont polygéniques, déterminées par l'expression de plusieurs gènes. A quoi il faut aussi rajouter l'intervention de facteurs non géniques, des facteurs du milieu qui modulent l'expression des gènes. Ces facteurs sont externes (d'origine alimentaire par exemple), ou internes: Ce sont des molécules qui accompagnent l'ADN et dont on sait aujourd'hui qu'elles peuvent moduler en + ou - l'expression des gènes (protéines du noyau, groupements méthyles…).
Du fait de l'absence de corrélation absolue entre le génotype MYBPC3 et le phénotype CMH1 caractérisé (en termes d'âge de déclenchement et de gravité), la CMH1 est vraisemblablement polygénique: D'autres gènes et/ou des facteurs non géniques corrigent ou amplifient les conséquences de la mutation. Ainsi peuvent s'expliquer les déclenchements plus ou moins précoces des symptômes cardiaques, leur gravité et leur vitesse d'évolution variables, tout comme leur absence chez certains chats âgés pourtant porteurs.
Ceci ouvre la discussion en terme d'élevage de la race. Comment intégrer ce qui est avéré (la mutation identifiée et sa conséquence sur la protéine C cardiaque) et ce qui est hypothétique (et à ce jour non identifié) ?
Il me semble que le principe de précaution induit obligatoirement l'élimination du facteur identifié du génome de la race. Ceci peut se faire sans perte de diversité allélique si le travail est rigoureusement conduit : On ne reproduit des chats porteurs qu'afin de conserver en élevage uniquement les produits non porteurs. Ceci ne nécessite pas une décennie de travail ! La mutation est identifiée depuis 2005 ! Le remplacement des reproducteurs avec conservation des lignées devrait déjà être très avancé voire proche de son achèvement.
Peut-on se fier aux inconnues de l'histoire ? Et à ce titre continuer à reproduire des chats porteurs pour divers arguments: Ils sont «trop beaux» ; leur lignée exprime tardivement ou pas du tout l'allèle morbide…On frôle ou on bascule là dans le prétexte. Il y a un choix de priorité à faire: La santé ou le type quand ou si on ne peut pas avoir la santé ET le type. Or la santé, c'est cartésien. Le type ne l'est pas. C'est la porte ouverte à de nombreuses dérives car on touche là à l'affectif humain qui est relatif et non pas absolu. Et si l'affectif est nécessaire pour conduire un élevage, encore faut-il séparer ce qui sert la race de ce qui ne sert que l'humain.
J'interpelle ceux qui font naître des Coons. Parmi eux, ceux qui se bouchent les oreilles et se voilent les yeux en prétendant ne rien savoir de cette pathologie et qui n'ont fait aucun dépistage sur les chats qu'ils reproduisent. Et ceux qui savent que leurs chats sont porteurs et continuent à vendre les chatons en reproduction, sans rien en dire aux acheteurs. Croyez-vous que j'invente ? Prenez donc votre téléphone, jouez au naïf et appelez. Et parcourez les forums. C'est édifiant !
Quelques compléments explicatifs
La mutation et sa conséquence sur la protéine
Un gène qui code pour la fabrication d'une protéine est composé de 2 brins. Chacun est une suite séquentielle de bases. Les 2 brins se lient par les bases qui sont complémentaires 2 à 2 :
- l'adénine A se lie à la thymine T
- La cytosine C se lie à la guanine G
Un seul des 2 brins de l'ADN est codant : Il contient le plan d'enchaînement des aminoacides de la future protéine. Toute la séquence de ce brin n'est pas utilisée pour la traduction en protéine. Elle comporte des exons, qui sont codants, intercalés avec les introns non codants (ils sont d'ailleurs épissés donc enlevés avant l'étape de synthèse de la protéine).
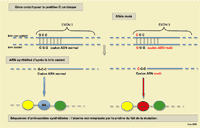
La mutation identifiée entraîne le remplacement d'un aminoacide par un autre : l'alanine est remplacée par la proline. Cette substitution va modifier la configuration spatiale de la protéine, sa structure tertiaire.
Or l'activité d'une protéine dépend directement de sa structure tertiaire : La partie active ne doit pas être déformée sous peine d'une perte plus ou moins complète d'efficacité. Une mutation peut donc modifier l'activité de la protéine synthétisée si elle se traduit par une modification de sa configuration spatiale.
Modélisation informatique de la forme spatiale
La configuration d'une molécule peut être modélisée par informatique : Des programmes ont été conçus afin de traduire la forme dans l'espace occupée par une séquence donnée d'aminoacides en reproduisant les liaisons chimiques qui se créent entre les acides aminés.
Processus d'analyse PCR pour cette étude
[traduction] «… l'ADN a été extrait de prélèvements buccaux ou d'échantillons de sang collectés dans des tubes EDTA. La partie du gène félin MYBPC3 qui contient la mutation a été amplifiée par PCR avec des oligo-nucléotides conçus à cet effet et des conditions de thermocycleur optimisées pour cette partie : Un cycle à 95°C (5 minutes) suivi par 43 cycles de 94°C (30 secondes), 57°C (30 secondes) et 72°C (30 secondes) avec une extension finale de 72°C (4 minutes) et ensuite maintenus à 4°C. Les échantillons amplifiés ont été séquencés en utilisant une séquence de prisme ABI 377. Les échantillons ont été enregistrés comme négatifs dans la base de données uniquement si la guanine était présente au codon 31 de l'exon 3 du gène félin MYBPC3 de l'échantillon ADN. Les échantillons ont été enregistrés comme hétérozygotes si de la guanine et de la cytosine étaient présentes dans cette partie, et ils ont été enregistrés comme homozygotes si seule la cytosine était présente dans cette partie…»
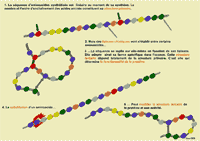
L'animation montre les étapes qui permettent d'amplifier une séquence d'intérêt que l'on veut étudier. Les amorces Courtes séquences de quelques nucléotides synthétisées pour être complémentaires d'une séquence repère de l'ADN. localisent et délimitent le point de départ de la synthèse du fragment qui doit être amplifié. La taq polymérase ADN polymérase: enzyme de synthèse de séquences d'ADN travaillant à des températures assez élevées est l'enzyme qui assemble les bases pour former le brin complémentaire.
On cherche dans l'ADN du chat la présence ou non de la mutation. Comme celle-ci est signalée par le remplacement de la guanine par la cytosine, la présence des 2 traduit l'hétérozygotie tandis que la présence de la seule cytosine traduit l'homozygotie pour la mutation (la seule présence de la guanine traduisant la présence de 2 gènes non mutés).

Le site source des données images sur l'insuline ; trèèèès beau travail !
Le site Genecards, source des données images de la protéine MYBPC3 humaine ; accrochez-vous !