Préalable
La traduction qui suit est longue et son contenu souvent assez aride car très technique. Nous avons délibérément choisi de ne faire aucune simplification et de n'ajouter qu'un minimum de notes afin de conserver la juste mesure de l'énorme travail réalisé par le Dr Pedersen (et la traductrice).
Pour un contenu plus accessible, vous pouvez consulter la traduction de l'entretien
Comprendre la Péritonite Infectieuse Féline
que lui même cite en référence dans son introduction et qui est paru sur le site Sockfip
.
Vous pouvez rejoindre directement chaque partie en cliquant dans la liste ci-dessous.
Bonne lecture
Introduction
Ce synopsis est extrait d'une revue bien plus importante et plus complète d'un point de vue scientifique de la littérature consacrée à la PIF pendant la période qui va de 1963 à 2008. Bien que plus technique que l'article publié sur le site SOCKFIP sous la forme de questions et réponses, il devrait être utile aux gens qui souhaitent avoir une connaissance plus approfondie de cette maladie. Nous espérons également que l'insertion de références prouvera la quantité de recherche évaluée par les pairs qui est effectuée sur la maladie et, je l'espère, fera prendre conscience aux lecteurs de l'état actuel de la prévention, du diagnostic et du traitement de la PIF. Les lecteurs seront aussi moins susceptibles de se fier à la masse d'informations anecdotiques et fréquemment incorrectes qui inonde le web.
1.Historique
La Péritonite infectieuse féline (PIF) a été décrite pour la première fois comme «une grave maladie des chats» par Holzworth (1963) à l'Angell Memorial Animal Hospital de Boston et un colloque clinico-pathologique sur cette maladie a été publié l'année suivante (Feldman et Jortner, 1964). On pensait que la maladie était infectieuse mais aucun agent étiologique spécifique n'a été identifié à cette époque. Wolfe et Griesemer (1966) ont été les premiers à suggérer que la PIF était causée par un virus. Zook et al (1968) ont observé des particules de virus dans les tissus de chats contaminés expérimentalement, mais ils n'ont pas été capables d'identifier l'agent. Ward (1970) a reconnu les grandes similarités du virus de la PIF (FIPV) dans les tissus avec des membres de la famille des Coronaviridæ. Montali et Strandberg (1972) ont été les premiers à rapporter que l'infection par le FIPV pouvait être soit granulomateuse (sèche, parenchymateuse) ou expansive (humide, non parenchymateuse). La proche parenté du FIPV et des coronavirus des chiens et des porcs a été rapportée pour la première fois par Pedersen et al (1978). La relation de cause à effet entre une infection par un virus entéritique félin commun (FeCV) et la PIF a été rapportée pour la première fois par Pedersen et collaborateurs (1981 b). Le fait que le FIPV est une forme mutante simple et assez fréquente du FeCV a été pour la première fois démontré par Vennema et al (1998). Après son apparition, l'incidence de la PIF a augmenté sans interruption et elle est actuellement l'une des plus importantes causes infectieuses de mort chez les jeunes chats dans les refuges et les chatteries. La raison de la soudaine émergence de la PIF n'est pas connue, mais il y a au moins trois explications possibles.
D'abord, les coronavirus peuvent s'être différenciés de façon spécifique chez le chat au cours des cinquante dernières années, ensuite il a pu se produire une modification génétique des souches de FeCV, et enfin les conditions de vie des animaux de compagnie ont très fortement évolué au cours des dernières décennies.
Il est remarquable que la PIF soit apparue dans la décennie qui a suivi les descriptions initiales de gastrœntérite transmissible (TGE) des porcs en Amérique du Nord (Hælterman 1962). Le virus cause de la PIF est fortement apparenté au TGEV des porcs et au coronavirus canin (CCV) (Pedersen et al 1978), bien qu'ils soient toujours différenciables génétiquement (Motokawa et al 1996). Cependant, on sait que des recombinants de ces trois virus apparaissent([Benetka et al 2006], [Herrewegh et al 1998], [Pedersen et al 1984] et [Wesley 1999]). Au moins une souche de coronavirus canin peut induire une entérite bénigne chez le chat et augmenter le risque d'infection ultérieure par le FIPV, ce qui indique une proximité particulière avec les coronavirus félins (McArdle et al 1992). De ce fait, le CCV peut être un parent plus probable du FeCV dans
ce scénario. Une seconde explication implique probablement une modification génétique spectaculaire mais
plus subtile des souches de FeCV qui prédominaient dans la population féline depuis les années 1960. Comme nous l'expliquerons ci-dessous, le virus qui cause la PIF est une simple mutation de l'omniprésent et peu remarquable FeCV. Les souches de FeCV qui existaient avant l'apparition de la PIF étaient peut-être résistantes à la mutation PIF. Une troisième possibilité implique les changements de la manière de
considérer les chats en tant qu'animaux de compagnie et la façon dont on s'en occupe dans cette ère moderne.
Il y a eu un changement spectaculaire dans le statut, l'entretien et l'élevage des chats comme animaux de compagnie après la seconde guerre mondiale. Le nombre de chats de compagnie a énormément augmenté, les animaux de pure race et l'élevage en chatterie sont devenus de plus en plus répandus, et de nombreux chats, notamment des chatons, se sont retrouvés en refuge. Ces grands environnements clos avec de nombreux chats sont connus pour favoriser le coronavirus entéritique félin (FeCV) et la PIF (vérifié par Pedersen et al 2008). Il est intéressant de noter que l'infection par le virus de la leucose féline (FeLV) est également devenue rampante dans les foyers à chats nombreux et confinés pendant cette période et l'infection par le FeLV était un co-facteur significatif pour la PIF jusqu'à ce que ce virus soit confiné dans la nature par la
pratique des tests, l'élimination/l'isolement, et finalement la vaccination dans les années 1970 et 1980 (Weijer et al 1986).
2. L'agent causal
Le virus de la péritonite infectieuse féline (FIPV) est une forme mutante (biotype) du FeCV ([Pedersen et al 1981b], [Poland et al 1996] et [Vennema et al 1998]). On ne peut donc pas comprendre la PIF et le FIPV sans comprendre l'infection par le FeCV. Le FeCV est une infection à coronavirus omniprésente chez le chat. On la trouve dans le monde entier et 40 à 80% des chats peuvent excréter le virus dans leurs fèces à tout moment (vérifié par Pedersen et al 2008). Le virus est transmis par voie fécale-orale et peut survivre jusqu'à deux semaines dans la poussière de litière. Il est aisément transporté d'un endroit à l'autre sur le corps et les vêtements des gens. L'infection par le FeCV est largement asymptomatique, elle cause d'éphémères vomissements et une diarrhée bénigne chez certains chats. Cette infection entéritique est rarement fatale en elle-même. Les chats peuvent excréter le virus pendant de nombreuses années, arrêter de le répandre après 6 à 9 mois environ, ou l'excréter par intermittence. Certains chats qui ont guéri de l'infection peuvent être réinfectés, même avec la même souche de FeCV, et leur mode d'excrétion ressemblera alors à celui de l'infection primaire.
On trouve systématiquement la mutation responsable du biotype du FIPV dans l'un des 11 gènes ou plus qui constituent le génome du FeCV, le gène 3c. Les mutations sont en général des polymorphismes nucléotidiques simples (SNPs) ou des erreurs de réplications nucléotidiques qui inactivent la totalité ou une partie du gène, empêchant ainsi la production d'une protéine 3c normale.
La mutation délétère spécifique est particulière pour chaque chat qui développe une PIF, même quand les chatons concernés sont de la même portée (Vennema et al.1998 ; NC Pedersen, UC Davis 2009, manuscrit en préparation). Ceci explique pourquoi les chats malades de la PIF ne semblent pas être contagieux pour les autres chats. Si la transmission de chat à chat existait, les isolats de FIPV de chats impliqués dans les mêmes contaminations présenteraient des mutations identiques du gène 3c. La perte de la fonction du gène 3c n'empêche pas la réplication du mutant (i.e. FIPV) in vivo ou in vitro, mais on pense qu'elle altère sévèrement le tropisme cellulaire en augmentant son intériorisation et la réplication chez les macrophages [(Dewerchin et al 2005] et [Rotter et al 2005]). Par contre, le FeCV parent infecte de préférence un type de cellule très restreint, les cellules matures qui se trouvent aux extrémités des villosités intestinales (Pedersen et al 1981 b).
La mutation du FeCV en FIPV se fait plus probablement pendant l'infection primitive et chez les chatons, parce que les deux conditions conduisent à un niveau de réplication du FeCV plus élevé (Pedersen et al 2008). Plus le taux de réplication est élevé, plus il est probable que des mutations se produisent. Les chatons très jeunes ont également une résistance moindre à la mutation lorsqu'elle se produit (Pedersen et al 2008). Des mutants FIPV étaient présents chez 20% des chats primo-infectés d'une étude (Poland et al 1996). Cependant, l'infection par le FeCV est souvent récurrente et on a quelques indices du fait que la PIF puisse aussi apparaître en conséquence de ces accès de réplication du virus. Addie et al (1995) ont suivi 56 chats réputés avoir des infections de FeCV récurrentes sur la base de titres d'anticorps qui montaient et descendaient ; 3 de ces 56 animaux ont ensuite développé une PIF.
3. Epizootiologie
La PIF surgit partout où on trouve le FeCV ([Addie et al 1995], [Foley et al 1997a] et [Pedersen et al 1981b, 1983a, b]) et elle est donc répandue dans le monde entier et omniprésente dans pratiquement toutes les populations de chats. Le FeCV est particulièrement endémique dans les populations de plusieurs chats comme les chatteries, les refuges et les maisons de particuliers comptant de nombreux chats. Cela empire en cas d'afflux constant de nouveaux chats, en particulier jeunes et chatons. Le FeCV est également très prévalent parmi les chats urbains abandonnés. Un tiers des chats adultes et 90% des chatons et des jeunes accueillis aux refuges de Sacramento, Californie, USA, excrètent le FeCV à leur arrivée (Pedersen et al 2004). Une proportion significative de ces chats provient de la population sauvage, il est donc juste de dire que le FeCV est endémique chez les populations de chats de maison comme celles de chats vivant à l'extérieur. De semblables conclusions ont été rapportées pour la plupart des pays, mais pas pour tous. Bell et al (2006a, b) ont trouvé que la séroprévalence du FeCV était de 34% chez les chats à pedigree de la région de Sydney et inexistante chez les chats sauvages testés.
Des études approfondies ont été faites sur les infections naturelles par le FeCV ([Addie et al 2001], [Foley et al 1976b] et [Pedersen et al 2008]) et sur les infections expérimentales ([Pedersen et al 1981b] et [Pedersen et al 2008]). La même souche tend à persister chez tous les chats d'une chatterie ou d'une région données ; cependant il peut arriver qu'un chat particulier d'un groupe soit infecté par plus d'une souche ou par une souche différente (Addie et al 2001). L'excrétion du virus est en quelque sorte associée aux niveaux de titres d'anticorps : des groupes de chats avec des titres d'anticorps mesurés par fluorescence indirecte supérieurs à 1:100 sont bien plus susceptibles de comporter des excréteurs de coronavirus que des groupes des chats avec des titres inférieurs à 1:25 (Pedersen et al 2008).
La plupart des décès dus à la PIF se produisent chez des chats de 3 à 16 mois et sont rares après 3 à 5 ans ([Pedersen 1976a] et [Pedersen 1983a]. Une étude a montré que la PIF est la cause unique (ndt : au sens un seul facteur cause le décès) de décès la plus fréquente chez les chats de moins de deux ans, alors que le cancer est la maladie la plus fréquente dans la tranche d'âge de 2 à 8 ans (Marioni-Henry et al 2004). De 1986 à 1995, l'incidence de la PIF dans un hôpital universitaire vétérinaire a été de 1/200 chez les nouveaux visiteurs félins, 1/300 sur tous les chats entrés, et 1/100 entrées aux laboratoires de diagnostics (Rohrbach et al 2001).
L'incidence de la PIF est significativement plus élevée chez les chatons et les jeunes chats issus d'élevages et de refuges. En moyenne 1 à 5 % des jeunes chats issus de chatteries ou de refuges meurent de la PIF, avec des pertes plus élevées dans les chatteries que dans les refuges. Des endémies avec plus de 10% de mortalité ont été notées au moins une fois en cinq ans parmi les jeunes chats et chatons issus des quatre chatteries de référence qui ont été étudiées (Foley et al 1997a). Cave et al (2002) ont étudié les causes de décès parmi 274 chatons à pedigree et sans pedigree, en refuge ou chez des propriétaires particuliers de 1986 à 2000. Vingt-cinq pour cent de la mortalité de tous les chatons était due au FPV (Parvovirus félin) (ndt : typhus). Les principales infections virales chez les chatons âgés de 15 à 38 jours étaient l'herpès virus félin et le calicivirus félin. La péritonite infectieuse féline a causé la mort de 17 chatons sur 203 pendant la période de post-sevrage (de 35 à 112 jours), soit une incidence de 8,4%.
Les pertes dues à la PIF sont endémiques ou épizootiques, le second cas étant le plus fréquent. Les pertes dues à la PIF sont sporadiques, imprévisibles et rares sous la forme endémique : des chatteries touchées par la forme endémique de la PIF peuvent ne pas avoir de décès pendant des années et ensuite plusieurs cas se succédant rapidement. La maladie peut disparaître, pour réapparaître des mois ou des années après. La mortalité globale due à une maladie endémique sur une période de 5 ans ou plus est habituellement de 1 à 5%. Cependant, des épizooties de 3 à 49% ont été observées dans des groupes de chatons élevés dans la même chatterie sur une période de 4 ans et de semblables épisodes et de telles attaques explosives ont été constatées dans plusieurs autres chatteries ([Pedersen 1983a] et [Potkay et al 1974]). Les épizooties de PIF durent rarement plus de 6 à 12 mois avant de retourner à l'état endémique. La PIF endémique est en général associée à la persistance de la même souche ou d'une souche similaire de coronavirus entéritique au sein d'une population, alors que l'épizootie est multi-factorielle et reflète un stress de la population accru, en général associé à la surpopulation avec une forte production de chatons, à l'usage non intentionnel de reproducteurs prédisposés génétiquement, à de possibles voies de transmission horizontale ou à l'introduction d'une nouvelle souche de FeCV.
Plusieurs facteurs de risques ont été identifiés pour la PIF dans les chatteries (Foley et al 1997a).
Dans cette étude la PIF n'a pas été associée de manière significative avec des chatteries précises, un
nombre de chats moyen, un âge moyen, le sexe, le titre médian en anticorps pour les coronavirus, la gestion et les pratiques de quarantaine, le fait que les chats soient en cage et les pratiques d'élevage, ou la prévalence de maladies concomitantes. Cependant, l'âge de chaque chat, le titre en coronavirus de chacun, la fréquence globale d'excrétion de coronavirus fécaux et la proportion de chats excréteurs chroniques dans la chatterie ont été associés avec un risque de PIF accru. Les décès dus à la PIF sont plus fréquents en
automne et en hiver, et sur la base de l'analyse des données de la chatterie, le nombre de morts varie
chaque année. Des épizooties (plus de 10% de taux de mortalité) ont été rapportées au moins une fois en 5
ans dans les 4 chatteries étudiées. L'un des facteurs les plus significatifs apparaît être
l'hypersensibilité génétique, qui représente jusqu'à 50% de l'incidence (Foley et Pedersen 1996). Les
maisons à plusieurs chats qui n'ont pas eu à domicile l'expérience de pertes dues à la PIF, mais qui ont «relogé» ou vendu des chats qui ont plus tard développé une PIF, ne se sont pas avérées plus susceptibles de faire l'expérience de la PIF sur une période de 6 ans que les maisons qui n'ont jamais eu de pertes dues à la PIF ou les chatteries qui ont perdu des chats à cause de la PIF (Addie et al 1995).
Cependant, chaque chatterie touchée par une infection au FeCV endémique risque de perdre des chats de la PIF si elle élève assez de chatons sur un laps de temps assez long. Le risque de PIF diminue au-delà de périodes de 3 ans dans les groupes de chats, ce qui indique une augmentation de la résistance de la population (Addie et al 1995).
L'incidence de la PIF dans les refuges semble être directement corrélée au nombre et à la densité de jeunes chats et au temps qu'ils sont gardés avant d'être adoptés, le plus grand nombre de chats et le laps de temps le plus long étant les pires risques (K. Hurley, UC Davis, résultats non publiés, 2008). Des rapports des Etats-Unis et d'Europe indiquent un risque accru pour les jeunes chats, les chats de pure race et les mâles entiers et un risque plus faible pour les femelles neutrées (Rohrbach et al 2001). Un rapport sur 42 cas de PIF confirmés en Australie entre 1990 et 2002 a montré que la PIF est sur-représentée chez certaines races pures (Burmese, Australian Mist, British Shorthair et Cornish Rex) et sous-représentée chez d'autres races (domestique à poil court, Persan) et qu'il y a une distribution plus égale sur le spectre des âges (Norris et al 2005). Une autre école vétérinaire a déterminé l'incidence de la race sur une période de 16 ans. La race, le sexe et le statut reproducteur des chats infectés ont été comparés avec ceux de la population féline générale et à ceux des chats croisés évalués pendant la même période (Pesteanu-Somogyi et al 2006). Comme pour les études précédentes, les chats non neutrés et les chats de pure race sont significativement plus susceptibles de faire l'objet d'un diagnostic de PIF, les mâles et les jeunes chats présentent également une prévalence plus élevée de la maladie. Les Abyssins, les Bengals, les Birmans, les Persans colourpoint, les Ragdolls et les Rex courent un risque significativement plus élevé, alors que pour les Burmese, les Exotic Shorthair, les Manx, les Persans, les Bleus russes et les Siamois il est réduit. De telles études indiquent que l'incidence de la PIF parmi les races peut varier énormément selon les pays et les régions, et que les pertes dues à la PIF sont probablement plus corrélées à des courants de sang (ndt : lignées) au sein d'une race qu'aux races elles-mêmes.
4. Caractéristiques cliniques
La péritonite infectieuse féline est principalement une maladie des chats domestiques. Elle a également été reconnue chez le lion d'Afrique, le lion des montagnes, le léopard, le guépard, le jaguar, le lynx, le serval, le caracal, le chat sauvage européen, le sand cat et le chat de Pallas ([Colby et Low 1970], [Colly 1973], [Fowler 1978], (Juan-Salles et al 1968], [Pedersen 1983a], [Pfeifer et al 1983], [Pœlmal et al 1974], [Theobold 1978], [Tuch et al 1974] et [Watt et al 1993]). Une péritonite infectieuse quasiment identique a été décrite chez des souris déficientes en interféron gamma ([Frances et al 1999] et [Kyuwa et al 1998a, b]) et chez les furets (Martinez et al 2008) infectés par leurs variétés respectives de coronavirus.
La péritonite infectieuse féline se rapporte à la forme la plus commune de la maladie : la forme effusive (humide, non parenchymateuse), un état inflammatoire transmissible de la membrane séreuse viscérale et de l'omentum avec exsudation dans l'abdomen (Wolfe et Griesener 1966). Une seconde forme de la maladie est caractérisée par une implication granulomateuse des organes parenchymateux comme les reins, les ganglions lymphatiques mésentériques, la paroi intestinale, le foie, le système nerveux central et les yeux ([Montali et Strandberg 1972] et [Pedersen, 1976a]). La PIF granulomateuse est appelée «sèche» ou non effusive, parce qu'il n'y a pas d'exsudation inflammatoire dans les cavités du corps.
La PIF la plus commune est l'humide, ou effusive, bien que la proportion de chats atteints de PIF sèche paraisse augmenter sur les dernières décennies. Les chats manifestent rarement les deux formes de la maladie en même temps, et dans ce cas c'est en général un stade de transition de l'humide à la sèche ou de la sèche à l'humide. Dans des conditions expérimentales, les chats qui développent une PIF sèche ont souvent un bref épisode de PIF humide au début, alors que certains chats qui ont une PIF sèche peuvent devenir plus effusifs au cours du stade terminal de leur maladie. Cependant, ces transitions se remarquent bien moins dans la nature.
La période d'incubation (délai de l'infection à la maladie) de la PIF humide est de 2 à 14 jours en conditions expérimentales ([Evermann et al 1981], [|Pedersen et Black 1983], Pedersen et Floyd 1985] et [Pedersen et al 1981a]). La période d'incubation en cas de PIF sèche provoquée de manière expérimentale est plus longue de plusieurs semaines. Cependant, la réelle période d'incubation pour les infections naturelles est inconnue, mais il est évident que l'infection peut couver à un stade sub-clinique pendant des semaines, des mois et même des années avant que des signes apparents ne soient remarqués. Rétrospectivement, le début de la PIF peut être précédé par une longue histoire de vague mauvaise santé et de croissance à problèmes. Des co-infections par d'autres pathogènes félins peuvent diminuer la résistance au FIPV ou compliquer ce tableau (voir la discussion de procédure).
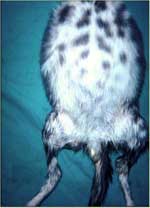
Les premiers signes de PIF déclarée, hormis une incapacité à bien se porter chez les jeunes chats, incluent un malaise qui empire progressivement, une fièvre fluctuante, un manque d'appétit, et une perte de poids. D'autres signes de maladie se superposent à ces signes de maladie basiques, suivant la forme de PIF et la distribution de la maladie dans les organes (table 1). On trouve le plus communément une distension abdominale en cas de PIF humide et elle se classe avant les maladies cardio-vasculaires, la néoplasie, les maladies hépatiques et les pathologies rénales comme cause d'ascite chez le chat (Wright et al 1999) (fig.1 ).
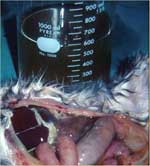
L'abdomen, outre le fait qu'il est très agrandi, est mou et douloureux à la palpation. Quand on ouvre, on constate que l'abdomen contient jusqu'à un litre de fluide visqueux, de teinte jaune, légèrement à modérément trouble (fig.2).
Des chats avec des effusions thoraciques et un problème pleural peuvent aussi présenter une dyspnée (tableau 1). On constate des signes cliniques dus à un système nerveux et oculaire touchés chez moins de 9% des chats malades de PIF humide (Tableau 1).
Il existe plusieurs aspects rares de la PIF humide qui méritent une mention. Les mâles entiers développent fréquemment un grossissement du scrotum dû à l'extension de la péritonite à l'enveloppe qui entoure les testicules et à l'œdème. Un syndrome de lipidose hépatique et d'extrême fragilité de la peau a été décrit chez un chat atteint de PIF humide (Trotman et al 2007). In utero, on a observé des infections par la PIF chez des chatons nés de mères qui avaient développé une PIF effusive au cours de la gestation : pneumonie, pleurésie et hépatite étaient les principales lésions chez les chatons infectés (Mc Kierman et al 1981). De nombreux chats atteints de PIF ont une inflammation généralisée des membranes des articulations (synovite), due au complexe immun ou à la migration des monocytes/macrophages infectés dans la membrane synoviale. Un chat atteint de PIF peut donc présenter des signes de fièvre et de faiblesse. Cela peut être confondu avec un autre signe d'infection ou une polyarthrite d'origine immune. Cependant, les signes de PIF les plus classiques se développent rapidement ensuite, rendant apparente la cause de la faiblesse.
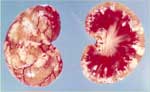
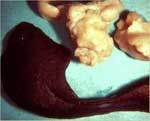
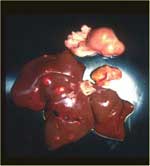
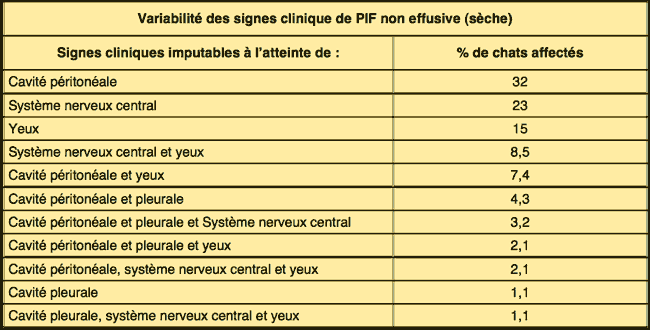
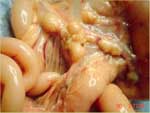
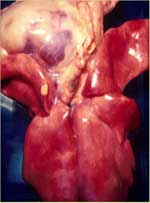
Comme le nom «PIF sèche» l'implique, les effusions thoraciques et abdominales sont soit absentes soit trop limitées pour être détectées autrement qu'à l'autopsie. Les yeux et/ou le système nerveux central sont touchés chez 60% des chats ayant une PIF sèche (tableau 2). Des signes imputables à une atteinte de l'abdomen sont observés chez 40% des animaux, avec ou sans maladie oculaire et du système nerveux central (tableau 2). Les lésions abdominales dues à la PIF sèche sont beaucoup plus étendues, moins nombreuses et moins répandues que celles dues à la PIF humide. Les lésions dues à la PIF sèche tendent à s'étendre vers le bas à partir des surfaces pleurales ou séreuses vers le parenchyme sous-jacent, d'où l'autre nom de «PIF parenchymateuse». On trouve fréquemment des lésions abdominales dans les reins (fig. 3) et les ganglions lymphatiques mésentériques (fig. 4 et 5), et quelque peu moins fréquemment dans le foie et les ganglions lymphatiques hépatiques.
L'atteinte de la paroi du cæcum et du côlon avec une lymphadénopathie du côlon et du cæcum est une forme spécifique de PIF sèche (fig. 6) associée avec des signes typiques de colique ulcérative (c'est-à-dire des selles molles avec du sang et du mucus) ([Harvey et al 996] et [VanKruiningen 1983]). Les lésions abdominales sont souvent évidentes à la palpation et parfois associés à une douleur locale. Environ 10% des chats atteints de PIF sèche ont une atteinte au thorax, mais les lésions thoraciques sont en général localisées et ne sont qu'une partie d'une infection plus systémique. De petits granulomes peuvent toucher la plèvre et le parenchyme pulmonaire sous-jacent. (fig. 7). L'atteinte du péricarde a été décrite et peut mener à une dilatation fluide du sac péricardique, une tamponnade cardiaque épanchement de liquide (sang en général) sous pression entre les deux feuillets du péricarde. Le coeur est alors comprimé et ne peut se remplir pendant la diastole. et une défaillance cardiaque (de Madron 1986).
Le système nerveux central est fréquemment touché chez les chats atteints de PIF sèche (table 2). Plus de la moitié des chats présentant une maladie inflammatoire du système nerveux central ont une PIF, tout comme un sixième du nombre total de chats présentant des symptômes d'atteinte du SNC dus à n'importe quelle cause (Bradshaw et al 2004). La PIF est aussi la maladie de la mœlle épinière la plus fréquente chez les chats de moins de 2 ans et l'une des trois causes les plus importantes de maladie de la mœlle épinière chez les chats de tous âges avec le lymphosarcome et la néoplasie vertébrale (Marioni-Henry et al 2004). La plupart des chats présentant une PIF du SNC ont moins de 2 ans et il sont souvent issus de grandes collectivités de chats (Foley et al 1998).
L'atteinte du système nerveux central chez les chats malades de PIF sèche est d'expression clinique variable, suivant les autres organes concernés (table 2), sa localisation exacte dans le système nerveux, et sa gravité. Les signes imputables à une atteinte de la mœlle épinière, comme une parésie postérieure, un manque de coordination, une hyperesthésie, des attaques et une paralysie des nerfs brachial, trijumeau, facial et sciatique ont été rapportées ([Holliday 1971], [Komegay 1978], [Legendre et Whitenack 1975], [Marioni-Henry et al 2005], [Pedersen et al 1976a], (Stauson et Finn 1972], [Quesnel et al 1997] et [Timmann et al 2007]. Une hydrocéphalie, consécutive à la maladie de la choroïde et de l'épendyme a aussi été rapportée ([Fankhauser et Fatzer 1977], [Hayashi et al 1980], [Krum et al 1975] et [Foley et al 1998] ; elle peut mener à la démence, des changements de la personnalité (agressions, rage, chat qui se cache/repli sur soi, etc.) ou des désordres convulsifs. Des symptômes vestibulaires cérébelleux comme un nystagmus, une inclinaison de la tête ou un chat qui tourne en rond ont aussi été causés par la PIF.
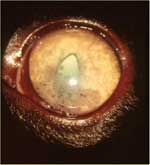
L'atteinte de l'œil, comme la maladie du système nerveux central, est plus susceptible de se produire chez les chats atteints de PIF sèche plutôt que de PIF humide (tables 1 et 2). L'uvéite et la choriorétinite sont les manifestations oculaires prédominantes de PIF sèche ([Campbell et Reed 1975], [Campbell et Schiessl 1978], [Doherty 1971], [Gelatt 1973], [Gillepsie et Scott 1973] et [Slausen et Finn 1972]. La PIF est aussi la cause la plus fréquente d'uvéite/choriorétinite chez les chats, d'autres causes moins fréquentes étant le lymphosarcome associé au FeLV, le traumatisme, l'endophtalmie phako-anaphylactique maladie de l'oeil, plus précisément de la chambre antérieure du globe oculaire faisant suite à une blessure du cristallin qui serait une maladie autoimmune. ([Goodhead 1996] et [Pfeffer et Wilcock 1991)]. En cas de PIF sèche l'atteinte oculaire se produit seule ou en association avec des lésions du système nerveux central ou de la cavité péritonéale (table 2). Un changement de coloration de l'iris est un fréquent signe précoce de PIF oculaire (fig. 8). Des précipités kératiques sur la partie arrière de la cornée sont caractéristiques de la PIF et sont dus à des accumulations de fibrine, de macrophages et d'autres cellules inflammatoires (fig. 9). Des lésions focales proches des granulomes des organes parenchymateux peuvent être apparentes dans l'iris et déformer la forme de la pupille (fig. 8 et 9).
Il existe plusieurs manifestations rares mais intéressantes de la PIF sèche. Une atteinte granulomateuse des tissus périphériques a causé un priapisme chez un chat castré (Rota et al 2007). Une orchite chronique fibrineuse et nécrosante peut faire apparaître le scrotum et les testicules plus importants ([Foster et al 1996) et [Sigurdardottir et al 2001]) et l'augmentation de volume du scrotum peut être l'une des premières affections visibles. Les fosses nasales, la langue et l'intestin grêle distal sont aussi des sites de lésions de PIF non effusive. Une syringomyélie maladie de la mœlle épinière liée au développement d'une cavité en son centre a été causée par l'atteinte du quatrième ventricule chez un chat (Kitagawa et al 2007). On a rapporté des lésions cutanées de type granulomateux chez un chat infecté par le FIV et atteint de PIF, on a pensé que les lésions étaient dues à une vasculite inflammation des parois des vaisseaux sanguins causée par le coronavirus (Cannon et al 2005). Une érythrodermie bulleuse rougeur de la peau avec épidermolyse a aussi été observée chez un chat malade de PIF sèche (NC Pederen, UC Davis, observation non publiée 2008). On a observé des papules intradermales non pruritiques, légèrement en relief, sur les parois du cou et de la poitrine aux stades terminaux d'un chat qui avait une PIF non effusive progressant vers l'effusive (Declercq et al 2008). La PIF a été identifiée dans les lésions de la peau par immunohistochimie.
Des lésions dues à la PIF ont aussi été confondues avec le cancer, en particulier le lymphome ([Kipar et al 1999] et [Kornegay 1978]. Un chat à PIF négatif au FeLV a par la suite développé une maladie myéloproliférative prolifération anormale de certaines cellules sanguines dans la mœlle. (Madewell et al. 1978). On a observé une gammapathie quantité anormale dans le sérum et/ou les urines d'une immunoglobuline. monoclonale chez quatre chats malades de PIF (Mac Ewen et Hurvitz 1977) et on a vu un cinquième chat malade de PIF passer d'une gammapathie polyclonale à une gammapathie monoclonale (Hurvitz 1982, comme cite dans Pedersen 1987).
La PIF a des interactions intéressantes avec d'autres agents infectieux. Ces agents peuvent affecter l'immunité au FIPV, comme l'infection par le FeLV. Ou alors, la PIF peut causer une immunosuppression qui encourage les pathogènes de type opportuniste. On a observé une infection concurrente par le FeLV chez un tiers à la moitié de tous les cas de PIF qui ont été testés dans les années 70 et 80 ([Cotter et al 1973] et [Pedersen 1976a]). Les infections par le FeLV semblent avoir un effet d'interférence particulier sur l'immunité continue au FIV. Les chats qui n'ont pas développé de PIF après une action expérimentale ont développé la PIF dans les 6 à 16 semaines après être devenus virémiques pour le FeLV, montrant que de nombreux chats qui ont guéri de la PIF gardent des infections résiduelles (Pedersen 1987a). En simulant la situation réelle, la PIF apparaît aussi après l'exposition naturelle aux deux virus ([Pedersen, 1987a] et [Pedersen et al 1977]). Avec l'élimination virtuelle du FeLV des populations félines dans les pays occidentaux, cette association est devenue moins fréquente.
Les chatons atteints de PIF clinique ou sub-clinique sont plus susceptibles d'avoir des infections des voies respiratoires supérieures causées par des mycoplasmes, la chlamydophila ou l'herpes virus, ce qui indique que leur résistance n'est pas normale. On sait aussi que les chats présentant une infection avancée par le FIV sont plus sensibles à la PIF quand ils sont exposés au FeCV (Poland et al 1966). La toxoplasmose systémique, une infection plutôt rare chez le chat, a été décrite chez deux chats atteints de PIF. Un rapport date de 1966 (Ward et Pedersen 1966) et un second de 1995 (Toomey et al 1995). La présence de la toxoplasmose systémique chez ces deux chats était probablement associée à la réactivation d'organismes enkystés résiduels d'une infection bien plus ancienne qui s'était arrêtée d'elle-même. La PIF est fréquemment associée à une lymphopénie, révélatrice d'une immunosuppression. Nous avons aussi noté l'augmentation des infections bactériennes chez les chats atteints de PIF, certaines se manifestaient comme septicité terminale ou infections locales plus chroniques des organes internes (NC Pedersen et P Pesavento, UC Davis, observations non publiées 2008). Une jeune chatte présentait une infection bactérienne chronique du tractus reproducteur qui s'était manifestée tôt par un écoulement vaginal purulent et finalement comme une infection récurrente de l'ovaire et de la trompe de Fallope, alors qu'un second chat avait une pneumonie bactérienne secondaire. Le stress de la gestation et de la parturition, les opérations chirurgicales telles que la stérilisation, la castration et le dégriffage ont aussi accru l'incidence de la PIF chez les jeunes chats, suggérant que le stress se produisant à un moment où le jeune chat combat une infection par le FIPV peut faire pencher la balance contre l'hôte (Pedersen 1976a).
5. Caractéristiques hématologiques, clinico-pathologiques et visibles par imagerie
Le diagnostic de la PIF devrait être relativement simple, étant donné son affinité avec les chats jeunes, sa forte tendance à concerner chatteries et refuges, les conclusions physiques et historiques typiques, et les nombreuses anomalies caractéristiques observables en laboratoire. Cependant, elle reste d'une certaine façon l'un des diagnostics les plus difficiles pour de nombreux vétérinaires.
La vérité est que les vétérinaires éprouvent peu de difficulté à placer la PIF très haut, voire au sommet de leur liste de diagnostic, mais ils ont beaucoup de difficulté et même de la réticence à confirmer leur diagnostic. Cependant, le vétérinaire n'est pas seul à avoir des difficultés, les propriétaires sont de même réticents à se résigner sans un diagnostic définitif.
On doit rappeler qu'un diagnostic peut être fondé sur des indices cumulatifs plutôt que sur un résultat de test unique, simple et définitif. Un jeune chat issu d'une chatterie ou d'un refuge avec une uvéite chronique et/ou des signes neurologiques, un taux élevé de protéines sériques, une hyperglobulinémie et une hypo-albuminémie, une fièvre fluctuante qui ne répond pas aux antibiotiques, une leukocytose avec une lymphopénie et une anémie chronique ne peut avoir qu'une PIF sèche si on se fonde uniquement sur les indices. De même, il est hautement improbable que le même chat avec une histoire et des résultats de laboratoire identiques, mais avec une ascite inflammatoire mucilagineuse de teinte jaune au lieu d'une uvéite et de signes neurologiques ait une autre maladie que la PIF humide. Les résultats d'un test dont il est dit à tort qu'il est définitif ou hautement indicateur de PIF ne feront que compliquer le problème et induire un doute alors que le diagnostic ne devrait pas être mis en doute. En fin de compte, la PIF doit être diagnostiquée en appliquant une connaissance exploitable de la maladie avec une pondération précise des indices, de l'historique, des signes cliniques, des résultats histo-pathologiques, de la sérologie et de l'examen des tissus ante ou post-mortem par histopathologie et immunohistochimie.
L'hémogramme des chats atteints de PIF montre souvent plusieurs anomalies qui tendent à être similaires quelle que soit la forme de la maladie. Une anémie de grade faible à modéré non détectable avec hypo-albuminémie est typique d'une maladie chronique. Les autres modifications hématologiques communes comprennent une leucocytose avec lymphopénie et neutrophilie indiscutables et une hyper-protéinémie ([Paltrinieri et al 1998], [Paltrinieri et al 2001], [Pedersen et al 1976a] et [Sparkes et al 1991]). L'augmentation totale des protéines sériques est associée à des niveaux de globulines accrus et d'albumine réduits. Les chats présentant des ganglions lymphatiques positifs au virus à l'autopsie sont significativement plus susceptibles d'avoir une augmentation de globulines (Paltrinieri et al 2001). L'hyper-gammaglobulinémie n'est pas directement reliée au titre en anticorps pour le coronavirus félin (Paltrinieri et al 1998), ce qui suggère que des globulines anticorps non spécifiques et/ou des facteurs complémentaires sont d'importants contributeurs à l'élévation de la globulinémie. Un ratio albumine/globuline inférieur à 0,6 est considéré comme diagnostic d'un processus inflammatoire, et le plus communément de la PIF (Hirschberger et al 1995). Les changements les plus réguliers montrés par l'électrophorèse des protéines sont une augmentation des globulines alpha 2 et gamma ([Paltrinieri et al 1998], [Pedersen 1976a] et [Sparkes et al 1991]). L'haptoglobine représente la majorité de l'augmentation des globulines alpha 2 (Harvey et Gaskin 1978).
Les effusions pleurales et abdominales de la PIF possèdent des caractéristiques aussi définitives que tout autre test unique. Presque la moitié de toutes les effusions chez le chat sont dues à la PIF (Hrischberger et al 1995) ; de ce fait la probabilité de PIF est de 50/50 en cas de présence d'une effusion seule. Si l'effusion présente les caractéristiques de la PIF, les probabilités sont plus élevées. Si le chat est jeune, les probabilités sont encore plus grandes ; s'il est issu d'un refuge ou d'une chatterie, les probabilités augmentent encore etc. Les effusions dues à la PIF sont habituellement d'un jaune clair à foncé, et parfois vertes, à cause du niveau élevé de bilirubine ou de biliverdine suivant le cas. Le fluide présente un caractère mucilagineux et si on touche une goutte sur une lame avec une pointe d'aiguille et qu'on la retire, il se forme souvent un filament. Le fluide peut être de presque clair à trouble et contient souvent des plaques de fibrine. Le contenu en protéines des effusions va de 3,9 à 9,8 mg/ul (ndt : unité lapine), les globulines représentant de 50 à 82 % du total (Sparkes et al 1991). Le nombre de cellules peut aller de 1600 à 25 000 par ul. Les macrophages, les neutrophiles non toxiques et les lymphocytes prédominent. Les effusions de fluide, en particulier celles de la cavité pleurale, peuvent être teintées par des cellules rouges. Les effusions forment souvent des caillots partiels quand on les laisse reposer dans un tube sans anticoagulant. Le modèle électrophorétique des effusions est similaire à celui du sérum correspondant (Paltrinieri et al 1998), mais comme les titrages comparatifs d'anticorps dans le sérum et le fluide cérébro-spinal ([Bœttcher et al 2007] et [Foley et al 1998]), la signification de ce résultat n'est pas déterminée. On peut faire un diagnostic définitif par examen immunohistochimique direct de cellules dans le fluide pour les antigènes viraux (Paltrinieri et al 1998, 1999). L'immunofluorescence est bien plus sensible que l'immunopéroxydase. L'analyse RT-PCR en temps réel des cellules d'effusions de PIF montre des niveaux élevés d'ARN viral.
L'hyperbilirubinémie et moins fréquemment l'hyperbiliverdinémie, souvent sans jaunisse, sont fréquentes chez les chats atteints de PIF, notamment de la forme humide. En fait, la PIF est la cause la plus fréquente de sérum ou plasma ictérique chez les chats de moins de 3 ans. L'urine est aussi de teinte jaune, à cause de l'hyperbilirubinurie. Une teinte verdâtre de l'urine et du sérum est moins fréquente et due à un taux élevé de biliverdine. L'augmentation du taux de bilirubine ou de biliverdine dans le sang n'est en général pas due à un problème de foie en soi, mais plutôt à des micro-hémorragies dans les tissus et à la destruction extravasculaire de cellules du sang par des cellules phagocytes, liée à la vasculite et à une coagulopathie intravasculaire (DIC) diffuse. L'hème provenant des cellules détruites est alors recyclé en biliverdine et finalement en bilirubine. Les chats n'ont pas de systèmes de transport permettant d'éliminer ces produits de décomposition de l'hémoglobine du sang, d'où leur tendance à les accumuler en effusions, lésions ou dans le sérum.
Les humeurs aqueuses et le liquide céphalo-rachidien chez les chats ayant une maladie oculaire ou du système nerveux central présentent aussi une augmentation des protéines et des leucocytes similaire, mais plus variable. Les résultats typiques d'examens du liquide céphalo-rachidien chez des chats atteints de PIF incluent une concentration en protéines supérieure à 200 mg/l et plus de 100 leucocytes par μl, la plupart étant des neutrophiles (Rand et al 1994). A l'opposé, le liquide cérébro-spinal des chats atteints d'une autre maladie virale a en général une concentration en protéines inférieure à 100 mg/dL et un nombre de globules blancs total inférieur à 50 cellules par μl. Singh et al (2005) ont défini qu'un liquide cérébro-spinal inflammatoire devait avoir un nombre total de cellules à noyau supérieur à 5 cellules/μl, ou que le nombre total de cellules est normal mais que leur répartition (differential counit) est anormale. Le sexe, le degré d'inflammation du liquide céphalo-spinal, l'emplacement neuro-anatomique et les signes systémiques fournis se sont pas utiles pour déterminer si l'inflammation est due à une PIF ou à d'autres maladies comme le cryptococcus, un lymphome ou un traumatisme. Le liquide synovial des chats atteints de PIF humide est souvent de caractère inflammatoire.
On utilise de nombreux tests des anticorps sériques pour le diagnostic de la PIF, y compris le test anticorps par immunofluorescence (IFA), neutralisation de virus et ELISA ([Barlough et al 1982], [Pedersen 1976c] et [Pratelli 2008]). Certains considèrent qu'ELISA est la procédure la plus sensible (Pratelli 2008) mais l'auteur considère que la plupart des tests d'anticorps sont équivalents s'ils sont pratiqués correctement. Le test le plus fréquent est une analyse par immunofluorescence qui utilise des cellules de porc ou de chat infectés par la gastro-entérite transmissible (Kummrow et al 2005) ou le FIPV (Pedersen 1976c) comme substrat. En général on lit les titres en multiples distincts de dilution de sérum (1:5, 1:25, 1:100, 1:400, 1:1600, 1:6400). Au départ on considérait qu'ils étaient utiles pour le diagnostic des chats atteints de PIF ou qui souffraient d'autres maladies (Pedersen 1976c). Malheureusement, les anticorps des coronavirus ne sont pas différents pour les chats infectés par le FeCV et le FIPV, et bien que des titres très élevés (> 1:1600) soient très suggestifs de PIF alors que des titres négatifs tendent à éliminer la PIF ([Hirschberger et al 1995] et [Pedersen 1976c]), le chevauchement des titres entre les chats sains exposés aux coronavirus et les chats malades est tellement important qu'il a une très faible valeur diagnostique définitive chez les animaux individuels ([Pedersen 1983a, b], [Paltrinieri et al 1998] et (Sparkes et al 1991]). Les titres augmentent progressivement chez de nombreux chats, au fur et à mesure qu'ils passent d'un stade subclinique à un stade clinique de la maladie (Pedersen et al 1987a). Cependant, on effectue rarement un suivi progressif des titres et ils sont généralement mesurés quand les signes de maladie apparaissent et que les niveaux de titres sont déjà en plateau (stabilisés). En outre, les titres peuvent aussi chuter de façon significative à la fin, en particulier chez les chats atteints de PIF humide foudroyante.
La sensibilité et la spécificité de la soi-disant sérologie de la PIF ont été mises en doute à maintes reprises. L'hématologie, les titres en anticorps et l'électrophorèse des protéines sériques de 48 chats malades de la PIF (34 atteints de PIF humide et 14 atteints de PIF sèche) ont été étudiés et comparés à ceux de 20 chats en bonne santé (Sparkes et al 1991). Dans la forme effusive, les titres en anticorps et l'électrophorèse des protéines des effusions ont été analysés. Il y avait des animaux séropositifs (titre en anticorps > 1:100) parmi ceux infectés par la PIF (73%) et les chats sains (70%). Sparkes et al (1991) ont aussi comparé les données sérologiques de 65 chats chez lesquels la PIF était considérée comme diagnostic mais qui finalement avaient une autre maladie. Ils ont trouvé que la présence de multiples anomalies compatibles avec la PIF augmentait la spécificité (c'est-à-dire diminuait les faux positifs) mais diminuait la sensibilité du diagnostic (c'est-à-dire augmentait les faux négatifs). Cependant, il est indubitable que les chats présentant un titre très faible ou négatif en anticorps du coronavirus félin (< 1:25) sont moins susceptibles d'avoir une PIF, alors que les chats présentant des titres très élevés (> 1:1600) sont plus susceptibles d'en avoir une. Etant donné ces limites, l'auteur recommande que les tests sérologiques ne soient utilisés que comme une aide permettant d'éliminer ou non la possibilité d'une PIF. Le diagnostic de PIF ne devrait jamais être établi uniquement sur un titrage d'anticorps, cette recommandation est faite par d'autres que moi ([Bell et al 2006b) et [Hartmann et al 2003]).
Il y a eu de nombreuses tentatives pour améliorer la spécificité et la sensibilité des tests de la PIF basés sur les anticorps. Un test commercialisé mesure les titres en anticorps sur la protéine 7b du coronavirus félin, en se fondant sur la présomption que le FeCV prototypique (WSU-79-1683) n'a pas de protéine 7b, alors que le FIPV prototypique (WSU-79-1146) a une protéine 7b intacte. En théorie, les chats atteints de PIF devraient avoir des anticorps pour la protéine 7b, alors que ceux exposés au FeCV commun n'auraient pas de tels anticorps. Malheureusement, l'absence de protéine 7b chez WSU-79-1683 est une caractéristique de cet isolat spécifique, et les souches de terrain de FeCV on un gène 7b intact (Herrewegh et al 1995). De ce fait, le test anticorps de la 7b n'est ni plus spécifique ni plus sensible que le test par immunofluorescence indirecte, et cela a été prouvé par des études publiées (Bell et al 2006b, Kennedy est al 2008).
A cause des caprices de la sérologie de la PIF, on ne doit pas utiliser les tests PIF par mesure des anticorps comme moyens de contrôle ou pour éliminer la PIF des chatteries. Les propriétaires de chatteries dépensent d'énormes quantités d'argent chaque année pour les tests PIF. Dans la plupart des cas, les résultats ne sont pas interprétables, même par les vétérinaires qui ont ordonné les tests. Virtuellement toutes les chatteries qui ont de 6 à 8 chats et un programme d'élevage actif ont le FeCV dans leur chatterie, et 50 à 80% ou plus de leurs animaux ont un titre de 1:1000 ou plus (en général de 1:25 à 1:1600). Tester la chatterie confirme ce qui est déjà connu : le FeCV est endémique dans la chatterie. Les titrages en anticorps ne répondent pas aux questions critiques :
- Est-ce qu'un des chats a réellement la PIF ?
- Est-ce que des chats sont infectés par la PIF de manière sub-clinique ?
- Est-ce qu'un chat en particulier développera une PIF à l'avenir ?
- Quels chats excrètent le FeCV ?
La surinterprétation et l'interprétation erronée de divers dosages des anticorps causent une mortalité considérable due à l'euthanasie absurde de chats en bonne santé et un stress émotionnel et financier injustifiés.
La sérologie est aussi utilisée pour la forme neurologique de la PIF. Foley et al (1998) ont observé ce qu'ils croyaient être une production féline spécifique d'anticorps anti-coronavirus dans le liquide cérébro-spinal. Ils ont trouvé que les indicateurs de PIF neurologique ante mortem les plus utiles étaient un titre positif en anticorps anti-coronavirus IgG dans le liquide cérébro-spinal, une concentration élevée de protéines sériques, et des résultats d'IRM suggérant une augmentation du contraste péri-ventriculaire, une dilatation ventriculaire et une hydrocéphalie. La valeur diagnostique des titrages positifs en anticorps anti-coronavirus dans le liquide cérébro-spinal a ensuite été mise en doute par Bœttcher et al (2007). Ils ont collecté du liquide cérébro-spinal provenant de quatre groupes cliniques :
- des chats atteints de PIF touchant le système nerveux central (n = 10),
- des chats atteints de PIF ne touchant pas le système nerveux central (n = 13),
- des chats atteints de désordres du système nerveux central causés par des maladies autres que la PIF (n = 29) et
- des chats atteints de maladies autres que la PIF et ne touchant pas le système nerveux central (n = 15).
On a analysé la concentration en érythrocytes, leucocytes et protéines totales du liquide cérébro-spinal. L'IgG anti-coronavirus a été mesurée dans le liquide cérébro-spinal et le sérum par immunofluorescence indirecte. Une IgG dans le liquide cérébro-spinal (1:32 à 1:4,096) a été détectée chez 12 chats, dont 6 présentant des manifestations neurologiques de PIF, 4 atteints de PIF ne touchant pas le système nerveux central, et 2 atteints de tumeur au cerveau. L'IgG du fluide cérébro-spinal n'a été détectée que chez des chats avec des titres aussi élevés en IgG dans le sérum (1:4,096 - 1:16,384) et significativement corrélée aux titres en IgG du sérum. Au cours d'une autre tentative de mesurer la production locale d'anticorps du système nerveux central chez des chats atteints de PIF, Steinberg et al (2008) ont utilisé un quotient en albumine et un index en IgG pour déterminer si les protéines dans le liquide cérébro-spinal (ou céphalo-rachidien ) étaient d'origine sanguine ou locale. Ni le quotient en albumine ni l'index IgG n'ont identifié une modèle cohérent avec la synthèse de l'IgG intrathécale chez les chats atteints de PIF neurologique. La conclusion de ces différentes études est que les anticorps aux coronavirus pénétrent dans le liquide céphalo-rachidien quand ils atteignent des taux très élevés dans le sérum. Des titres de sérum élevés sont susceptibles d'être associés à la forme sèche de la PIF (Pedersen et al, 1976a), la plupart des cas de PIF neurologique étant de type PIF sèche (tableau 2). De ce fait, on peut associer à la PIF des titres positifs en anticorps au coronavirus félins dans le liquide céphalo-rachidien.
On a développé des tests pour la présence d'ARN du FIPV, mais ils souffrent de nombre des mêmes faiblesses que la sérologie. Certains des tests PCR les plus populaires sont fondés sur l'absence du gène 7b chez le prototype FeCV WSU-79-1683 et sa présence chez le prototype FIPV WSU-79-1146. Comme mentionné plus haut, l'absence du gène 7b chez cet isolat précis est un artefact, probablement du à une adaptation à la culture de tissu. De ce fait, les tests PCR fondés sur les différences génétiques entre WSU-79-1146 et WSU-79-1683 ne sont pas valables. En outre, les tests PCR sont notoirement sujets à la contamination en laboratoire par les produits ADN destinés à l'amplification. De nombreux laboratoires commerciaux effectuent ces procédures de manière incontrôlée. Pour tenter d'augmenter la spécificité et la sensibilité, on a développé une PCR qui ne détecterait que les formes d'ARN viral qui étaient présentes au cours de son stade de réplication (Simons et al 2004). La justification était que les formes de l'ARN viral qui se répliquent ne peuvent être trouvées que dans le sang des chats ayant la PIF. Le test a été conçu pour amplifier l'ARNm subgénomique du gène très conservé M. Le test a été appliqué à 424 chats sains et à 651 chats suspectés de PIF. Presque la moitié des chats malades étaient positifs pour la forme réplicante du mRNA du coronavirus félin dans leurs cellules sanguines périphériques alors que seulement 5% des chats sains étaient positifs. 75 sur 81 chats (93%) atteints de PIF confirmée post-mortem étaient positifs au test, alors que 17 cas non atteins de PIF étaient tous négatifs. On n'a pas trouvé de tels résultats lorsque le même test a été appliqué à un autre groupe de chats. Pour cette étude, on a collecté 26 échantillons sanguins de 25 chats sains et d'un chat présentant des signes cliniques suggérant une PIF : à savoir fièvre, perte de poids, abdomen distendu et ascite (Can-Sahna et al 2007). Les échantillons de sang ont alors été testés pour la réplication de l'ARN messager du coronavirus félin par la procédure de Simons et al (2004). Quatorze chats (54%) étaient positifs pour le FCoV, y compris le chat avec la maladie clinique, mais on a observé un taux élevé de positivité chez les chats sains, ce qui suggère que les coronavirus félins peuvent être présents dans les échantillons sanguins des chats sains comme des chats présentant une PIF clinique. Cette suggestion a été confirmée pour les chats sains par d'autres ([Kiss et al 2000] et [Meli et al 2004]). Ces résultats contradictoires mènent à se poser la question de la valeur de la PCR pour tester le sang. Cependant, la RT-PCR a différencié précisément les effusions dues à la PIF de celles dues à d'autres causes (Hartmann et al 2003). Le problème de la contamination en laboratoire par des produits de PCR peut être virtuellement éliminé en utilisant une technique appelée PCR en temps réel (TaqMan).
Certains vétérinaires et propriétaires de chatterie testent pour le coronavirus félin dans les fèces par PCR pour tenter d'identifier les porteurs de FeCV dans un des groupes de chats et éliminer les excréteurs de l'environnement, dans le but d'éviter les pertes dues à la PIF. Le FeCV est excrété à de hauts niveaux mais le taux de portage est de 40 à 80%, voire plus élevé chez les populations à nombreux chats, et l'excrétion est intermittente et les infections récurrentes (revu par Pedersen et al. 2008). Les inhibiteurs PCR ont été décrits dans les fèces, il est donc important de purifier l'ARN viral en utilisant certaines méthodes (Dye et al. 2008). Un tel test est onéreux, et seuls certains laboratoires peuvent l'effectuer de manière fiable sur une base commerciale. Cependant, en final, il est virtuellement impossible de garder un groupe de chat non contaminé par le virus, même si l'infection peut être éliminée, sans des installations de quarantaine stricte et des mesures, comme la restriction des mouvements des chats et des gens entre les populations de chats (voir traitement et prévention).
Le test Rivalta a eu beaucoup de succès pour le diagnostic de la PIF humide (Hartmann et al 2003). Un tube à essai est rempli d'eau distillée et on y ajoute une goutte d'acide acétique à 98%, puis une goutte d'effusion pleurale ou péritonéale. Si la goutte se dissipe dans la solution, le test est négatif et si la goutte garde sa forme, le test est positif. On rapporte que le test Rivalta est fiable à 97% pour éliminer la PIF, alors qu'un test positif n'est fiable qu'à 86% pour incriminer une PIF. L'auteur considère que ce test n'apporte aucune amélioration de valeur diagnostique par rapport à l'analyse de routine de fluide, brute, microscopique et biochimique, mais c'est un test d'appoint simple et bon marché.
On utilise plusieurs tests indirects, en général basés sur le niveau de certaines protéines inflammatoires ou de produits annexes (substances caractéristiques de la phase aiguë) pour détecter les conditions inflammatoires chez les chats, et en particulier la PIF (revu par Paltrinieri 2008). L'alpha-1 glycoprotéine acide (AGP) est une protéine caractéristique de la phase aiguë dont la concentration augmente dans des conditions infectieuses et inflammatoires. On a trouvé que les concentrations d'AGP dans le sérum et le fluide péritonéal étaient utiles dans le diagnostic de la péritonite infectieuse féline (PIF) ([Bence et al 2005] et [Savério et al 2007]). L'AGP et l'amyloïde A augmentent toutes deux quelques heures après le stimulus inflammatoire et restent élevées tant que l'inflammation persiste, et elles ont été mesurées chez le chat. Le niveau d'AGP sérique a aussi été utilisé pour étudier la PIF chez des groupes de chats (Paltrinieri et at 2007). On a observé que la concentration d'AGP dans le sérum fluctue dans le temps chez les chats cliniquement sains issus de chatteries avec la plus haute prévalence de PIF et augmentent de façon significative juste avant un accès de PIF. Bien que des niveaux d'AGP et d'autres protéines inflammatoires accrus soient particulièrement communs chez les chats atteints de PIF (Saverio et al 2007), ils ne sont pas spécifiques. Le niveau d'AGP est habituellement élevé chez les chats atteints de PIF et d'autres maladies inflammatoires, un niveau d'AGP sérique modéré (1,5-2 mg/ml) peut discriminer la PIF d'autres maladies qui ont une faible probabilité avant le test, alors que des niveaux d'AGP sérique élevés (>1,5-3 mg/ml) ne sont en général pas constatés chez des chats atteints de maladies autres que la PIF ([Duthie et al 1997] et [Saverio et al 2007]). Cependant, la spécificité de l'augmentation du niveau d'AGP a été mise en doute par d'autres (Duthie et al 1997). La valeur potentielle de niveaux augmentés de substances caractéristiques de la phase aiguë, alpha 1 glycoprotéine acide (AGP) et haptoglobine dans le diagnostic de la PIF, a été étudiée chez des chats atteints de PIF confirmée et des chats avec un autre statut. On a trouvé que des niveaux d'AGP supérieurs à 1,5 g/litre dans des échantillons de sérum, de plasma ou d'effusions ont une valeur pour distinguer des cas de PIF de terrain de chats avec des signes cliniques similaires et permet de différencier ces deux groupes de manière plus efficace que le ratio albumine/globuline. La concentration d'haptoglobine était plus élevée chez les chats atteints de PIF que dans le groupe de chats sains, mais pas assez pour avoir une valeur diagnostique. Des échantillons de sérum prélevé sur des chats infectés par le FIV présentaient aussi des niveaux d'AGP et d'haptoglobine significativement augmentés, ce qui illustre que des niveaux accrus de ces protéines inflammatoires ne sont pas pathognomoniques (ndt : caractéristique d'une seule maladie) de la PIF. Les modifications de l'AGP ont aussi été testées pour augmenter sa spécificité (Ceciliani et al 2004). L'AGP chez l'homme est fortement glycosylée et subit diverses modifications de son fragment moléculaire glycane pendant les phases inflammatoires aiguës et chroniques. En utilisant des adaptations du test humain, on trouve que l'AGP féline a très peu de résidu de L-Fucose à sa surface et que son degré de ramification est très bas dans des conditions normales comme pathologiques. Par contre, l'AGP féline subit plusieurs modifications pendant la PIF aiguë, y compris une expression moindre des acides sialiques liés alpha(2-6) et alpha(2-3) (respectivement 76 et 44%) quand on les compare à de l'AGP féline non pathologique. Giordano et al (2004) ont aussi rapporté le rôle possible de certaines protéines et immunoglobulines de phase aiguë (inflammatoire) dans la pathogenèse et le diagnostic de la péritonite infectieuse féline (PIF). L'électrophorèse des protéines sériques et la concentration en haptoglobine (Hp), amyloïde sérique A (SAA), acide glyco-protéique alpha(1) (AGP), IgG et IgM ont été évalués chez des chats sains exposés au coronavirus et chez des chats atteints de PIF. La plus haute concentration de protéines caractéristiques de la phase aiguë a été détectée chez les chats affectés, ce qui confirme le rôle de ces protéines pour conforter un diagnostic clinique de PIF. Il est intéressant de noter que les chats sains exposés au coronavirus présentaient aussi une augmentation des protéines caractéristiques de la phase aiguë au moment où des membres du groupe de PIF déclarée ont été ajoutés à ce groupe. Cependant, cette augmentation n'a perduré que chez les chats qui développaient une PIF.
Il est manifeste au vu de ces différentes études que le niveau d'AGP, comme celui des autres protéines caractéristiques de la phase aigue, change radicalement en cas de PIF, mais qu'aucun de ces changements n'est significatif par lui-même.
L'imagerie par résonance magnétique (IRM) s'est avérée utile pour confirmer la présence d'une maladie neurologique inflammatoire indiquée par l'analyse du liquide céphalo-rachidien (Negrin et al 2007). Quatorze chats atteints de maladies inflammatoires affectant le liquide céphalo-rachidien ont été étudiés, dont huit chats atteints de PIF et deux de toxoplasmose. On a observé des anomalies affectant le système nerveux central par images de résonance magnétique chez 10 chats sur 14 (71%). Des lésions intra-crâniales se sont révélées des foyers légèrement hypointenses sur les images T1 chez deux chats, et des foyers hyperintenses après l'administration intraveineuse d'un produit de contraste à base de gadolidium chez 10 (71% des chats). Chez 6 chats avec des lésions sur les images T1 et/ou T2, des lésions additionnelles étaient visibles sur les images T1 obtenues après l'injection du produit de contraste à base de gadolidium. Chez trois chats, les lésions n'ont été visibles qu'après l'injection du produit de contraste. Dans cette étude, l'IRM n'a pas détecté tous les cas d'inflammation du système nerveux central dans une population de chats présentant une inflammation du liquide cérébro-spinal. Cependant, elle a apporté une information importante sur l'emplacement des lésions, qui peut être important pour différencier la PIF d'autres situations inflammatoires. Cela a confirmé les conclusions d'une précédente étude par IRM de chats atteints de PIF neurologique (Foley et al 1998). On y avait étudié ante et post-mortem seize chats atteints de PIF neurologique confirmée et huit chats de contrôle atteints de PIF non neurologique. L'IRM a montré une augmentation du contraste péri-ventriculaire, de la dilatation ventriculaire, et d'hydrocéphalie chez les chats atteints de PIF neurologique.
La règle d'or actuelle pour le diagnostic de la PIF est l'immunohistochimie sur les effusions ou les légions qui contiennent des macrophages infectés. On a utilisé des anticorps monoclonaux ou polyclonaux qui sont hautement spécifiques du coronavirus félin et qui réagissent bien aux tissus fixés au formol (Tammer et al 1995). On peut rechercher directement le virus dans des sections de lésions ou de fragments de cellules issus de fluides ascétiques ou pleuraux en utilisant de la fluorescéine ou des anticorps polyclonaux ou monoclonaux de péroxydase de raifort. La détection d'antigènes de coronavirus dans les effusions de PIF est très spécifique, mais moins sensible que la détection d'antigènes viraux dans des lésions parenchymales caractéristiques de la PIF. Hirschberger et al (1995) ont identifié l'antigène dans 34 effusions de PIF avérées sur 49, alors que 50 effusions dues à d'autres causes étaient négatives. La spécificité de l'immunohistochimie est dépendante des anticorps polyclonaux ou monoclonaux utilisés et de la localisation caractéristique de l'antigène du FIPV dans les macrophages ([Paltrinieri et al 1998] et [Tammer et al 1997]). La sensibilité du test dépend de la présence sur les lames de macrophages infectés dans les tissus ou les cellules d'exsudat. Pour cette raison, la biopsie aléatoire de foie ou de rein de chats atteints de PIF échoue souvent à fournir l'antigène du FIPV par immunohistochimie (Giordano et al 2005), et la même chose est vraie pour la PCR en temps réel. La sensibilité est de 5 à 10 fois plus élevée avec la fluorescéine que la coloration par le péroxyde de raifort, mais ce dernier a l'avantage d'utiliser des tissus fixés au formol et inclus dans de la paraffine, alors que le précédent nécessite des sections de tissus congelées. Tous deux peuvent être utilisés aussi simplement sur des lames de cellules récoltées dans les effusions et fixées à l'acétone.
L'isolement du virus sur une culture de tissu n'est pas encore possible pour les FeCV et est difficile pour la plupart des souches de terrain de FIPV. Le sérotype II du FIPV semble mieux se développer en culture de tissu et pousse souvent sur le rein félin de Crandelle (Crfk) et le fœtus entier de Felis Catus (Fcwf-4 cellules). La dernière lignée de cellule est celle de lignée macrophage Jacobse-Geels et Horzinek (1983) et c'est celle que l'on préfère pour l'isolement du sérotype I FIPV ([Pedersen et al 1981a] et [Pedersen et Floyd 1985]). Le coût et le faible rendement de l'isolement par culture de cellules interdit son application de routine au diagnostic clinique.
Suite à l'introduction des tests pour la détection de l'infection par le FeLV, on a trouvé qu'un tiers ou plus des chats atteints de PIF présentaient une infection concomitante par le FeLV (Cotter et al 1973, 1975). Avec l'élimination du FeLV de nombreuses chatteries et maisonnées de chats de compagnie, et le déclin constant de l'incidence du FeLV dans la totalité de la population de chats, la proportion de chats atteints de PIF et d'une infection concurrente par le FeLV a grandement diminué. Actuellement, virtuellement tous les cas de PIF chez les chats de chatterie de pure race sont négatifs au FeLV et l'infection par le FeLV est détectée chez 10% ou moins des chats de compagnie domestiques atteints de PIF.
6. Traitement et prévention
Il faut tout d'abord rappeler qu'aucun traitement n'a fait preuve de son efficacité pour soigner les chats atteints de PIF, malgré les affirmations. Les chats qui développent une PIF meurent inévitablement de leur maladie dans les jours, les semaines ou les mois qui suivent.
La raison de ces nombreuses fausses affirmations est incertaine, mais des rémissions spontanées peuvent compter pour au moins certains rapports et erreurs de diagnostic. Des chats présentant des signes oculaires et aucune autre manifestation systémique de PIF ont parfois eu une rémission avec uniquement un traitement symptomatique. Des chats présentant une fièvre chronique, des ganglions lymphatiques mésentériques au volume augmenté qui étaient histologiquement compatibles avec la PIF et des taux de coronavirus élevés sont entrés en rémission sans traitement. Certains chats sans signes apparents de PIF ont montré des lésions fibreuses sur la rate et le foie lors d'une autopsie pratiquée pour d'autres raison, ce qui indiquait un accès de PIF antérieur. On a aussi trouvé de petites lésions inactives dans le foie et les ganglions lymphatiques mésentériques chez des chattes par ailleurs en bonne santé au cours d'ovario-hystérectomies de routine.
Donc, il existe des rémissions spontanées et, pour le moins, certaines de ces réponses naturelles peuvent avoir coïncidé fortuitement avec divers traitements. On a tout d'abord rapporté des traitements à la tylosine et à la prednisolone (Colgrove et Parker 1971), initiant une décennie d'utilisation de la tylosine pour le traitement de la PIF. Cependant, la tylosine n'a aucun effet sur la PIF. Il est intéressant de noter qu'une proportion significative de chats atteins de PIF sont toujours traités par antibiotique d'un type ou autre. Certains chats sont entrés en rémission après utilisation de prednisolone et de phénylalanine mustard (ndt Melphalan) ou de cyclophosphamide (Pedersen 1976a). Un autre chat a été «traité» avec succès avec de la prednisolone et du Melphalan (Madewell et al 1978). Aucun traitement à base de médicaments immunosuppressifs n'a survécu à l'épreuve du temps.
Quantité d'autres traitements non-spécifiques tout aussi douteux ont été utilisés pour la PIF, presque tous sur un nombre insuffisant de patients, une documentation insuffisante sur l'infection ou un manque des essentiels contrôles par placebo et double aveugle (Hartmann et Ritz 2008). Le FIPV est très sensible in vitro aux interférons humains alpha et omega (Weiss et Toivio-Kinnucan 1988). L'interféron félin omega inhibe aussi la PIF in vitro et est disponible dans le commerce dans de nombreux pays (Mochisuki et al 1994). D'après certaines informations, l'interféron félin omega induisait une rémission complète ou partielle chez les deux tiers des chats atteints de PIF (Ishida et al 2004). Cependant, au cours d'une étude plus importante et en double aveugle, on a trouvé que ce traitement était totalement inefficace (Ritz et al 2007). On a utilisé divers immunosuppresseurs comme les glucocorticoïdes et la cyclophosphamide ; ces médicaments peuvent prolonger la vie mais n'empêchent pas l'issue fatale (Hartmann et Ritz 2008). On a aussi plaidé pour les immunostimulants, des doses massives de vitamines, et de nombreux compléments alimentaires mais ils se sont avérés sans utilité. On a utilisé de la pentoxyfiline, un inhibiteur du facteur alpha de nécrose tumorale (ndt : inhibiteur du TNF-α) (Zabel et al 1993) sur des chats atteints de PIF en se fondant sur son intérêt pour le traitement de certains types de vasculites humaine et féline (Nichols et al 2001). Le TNF-alpha (ndt : facteur de nécrose tumorale α) est régulé positivement en cas de Pif (Kiss et al 2004) et la PIF est essentiellement une vasculite. Cependant, ce traitement n'a pas fait preuve de son efficacité et n'est plus utilisé. Nous avons traité un chat atteint de PIF avec de l'interféron félin gamma et un inhibiteur du TNF-α (pentoxifylline), sans aucun effet bénéfique.
Les vaccins efficaces on été tout aussi illusoires que les traitements efficaces. Pedersen (1989) a émis l'hypothèse que le vaccin FIPV idéal devrait contenir un virus vivant qui persisterait dans le corps à l'état subclinique, induisant un état précurseur d'immunité. Cependant, un vaccin efficace contre la PIF n'a pas été développé, bien que la plupart aient été basés sur cette hypothèse. Les chats qui survivent à l'infection par une dose de virus augmentée progressivement, en commençant par des niveaux sub-létaux, semblent développer un type d'immunité (Pedersen et Black 1983). Cependant, cette approche n'est pas applicable cliniquement parce qu'il y autant de chats qui meurent que de chats qui s'immunisent, et l'immunité paraît être très faible. Certains chats qui semblaient avoir résisté à la maladie ont développé une PIF des mois ou des années après, indiquant la persistance d'infections subcliniques. Ce résultat a été conforté par une étude ultérieure de Baldwin et Scott (1997). Ils ont d'abord immunisé des chats en intratrachéal par une dose sublétale de FIPV virulent, puis une forte dose de virus atténué par la chaleur. Les chats ont démontré leur immunité lors d'un contact avec un FIPV très virulent en aérosol, mais on a trouvé des lésions résiduelles après autopsie, ce qui suggère que l'immunité était ou partielle ou de type précurseur. Les premiers essais d'utilisation d'une souche vivante atténuée de FIPV, FIPV-black high passage pour induire une immunité ont échoué à procurer une protection et ont même causé une facilitation immunologique prolongation de la survie des cellules tumorales d'animaux immunisés par l'antigène de la tumeur ; des anticorps facilitateurs empêchent une réponse contre ces antigènes. (ndt : ou facilitation immunitaire). On a ensuite rapporté un résultat similaire pour une souche à virulence atténuée de FIPV-UCD1 (Kiss et al 2004). Le phénomène de facilitation induite par le vaccin FIPV a récemment été vérifié et est commun à de nombreuses approches vaccinales (Huisman et al 2008).
Un mutant thermosensible du FIPV-79-1146, administré par voie intranasale, a ensuite été développé et des études collectives ont montré un degré élevé d'efficacité lors d'une infection avec un FIPV-79-1146 très virulent ([Christianson et al 1989] et [Gerber et al 1990]). L'immunité a été attribuée à une réponse locale des IgA et une réponse cellulaire systémique mesurée par la prolifération des lymphocytes induite par le FIPV. Ce vaccin est administré en deux doses intranasales, à trois semaines ou plus d'intervalle, à partir de 16 semaines, ou plus tard. Sans doute, on n'a pas pu prouver son efficacité pour les chats vaccinés et/ou exposés à une contamination à un âge plus jeune. Ce vaccin commercialisé a été étudié sur le terrain dans un unique grand bâtiment de refuge, qui abritait au moins mille chats ([Postorino-Reeves et al 1992] et [Reeves et al 1992]). Cinq cents chats négatifs au FIV/FeLV et aux anticorps au coronavirus félin ont été divisés en deux groupes avant d'être mis dans cet environnement. La moitié a reçu le vaccin vivant intranasal et l'autre moitié a reçu un placebo. Les chats ont été suivis 16 mois. Le nombre de morts a été le même dans les deux groupes. Cependant, deux chats du groupe vacciné ont développé une PIF pendant les 16 mois et 8 chats non vaccinés ont succombé à la maladie. La protection n'a pas été convaincante dans cette étude, et la pertinence de l'utilisation du vaccin uniquement sur des chats négatifs au coronavirus ainsi que la mesure de la protection sur une période de temps limitée ont été mises en doute (Wolf 1997).
Hoskins et al (1994) ont vacciné 20 chats indemnes de pathogènes spécifiques par voie intranasale à 16 et 19 semaines, et ont ajouté 20 chats non vaccinés pour contrôle. Les 40 chats ont été exposés à une infection par voie orale à 23 semaines par FIPV-DF2 (c'est-à-dire FIPV-79-1146). Un chat vacciné et cinq non vaccinés ont développé une PIF humide et ont été euthanasiés. Cependant, 6 des chats vaccinés restants et 12 des chats de contrôle présentaient une évidence histologique de PIF à leur autopsie, 8 semaines après. Wolf (1997) a critiqué cette étude parce qu'elle utilisait une souche de contamination homologue et que les chats n'ont été suivis que 8 semaines.
Au cours d'une autre étude de terrain, le vaccin a échoué à prévenir la PIF chez des chatons de chatterie immunisés en présence d'anticorps FeCV pré-existants (Fehr et al 1997).
Les problèmes de spécificité du sérotype (c'est-à-dire que le vaccin lutte contre le sérotype II, alors que la plupart des isolats de terrain sont de sérotype I), l'interférence avec les anticorps maternels, la nécessité de ne vacciner qu'à au moins 16 semaines, et la relativement faible efficacité sont de sérieuses limites. Ce vaccin est toujours commercialisé et utilisé par certains vétérinaires. Il a prouvé son innocuité sur une longue période d'utilisation et ne semble pas aggraver la maladie (Reeves et al 1992). Cependant, son degré d'efficacité dans la population générale de chats, où l'incidence de la PIF est très faible, et dans des chatteries et des maisonnées de plusieurs chats où tous les individus de 16 semaines sont déjà séropositifs, et donc ne répondent pas au vaccin, est hautement discutable.
La réactivité croisée du sérotype est aussi un problème. La protection croisée entre des virus étroitement apparentés comme le TEGV ou le CCV et le FIPV soit ne se réalise pas, soit est faible ([Stoddard CA et al 1988], [Woods 1984] et [Woods et Pedersen 1979]). De ce fait, la protection croisée entre les sérotypes est douteuse, elle peut même varier entre divers isolats du même sérotype de FIPV (Pedersen 1987c). Les chats infectés par FIPV-UCD2 ne deviennent pas malades et ne développent pas d'immunité protectrice contre l'exposition à des souches plus virulentes. Les chats qui ont guéri du FIPV-UCD3 tendent à être immunisés contre l'exposition au FIPV-UCD1, alors que les chats qui ont guéri du FIPV-UCD4 n'ont pas de bonne immunité protectrice contre le FIPV-UCD1.
Beaucoup de vaccins potentiels différents fondés sur la technologie recombinante ont été décrits dans la littérature depuis 1990. On a testé un virus vaccin issu du génie génétique qui exprimait la protéine qui enveloppe le FIPV (Vennema et al 1990) ; il créait une infection virulente par le FIPV plutôt que de protéger les chats. Wasmœn et al (1995) ont développé un recombinant de variole du raton-laveur qui exprimait le gène encodant la protéine de nucléocapside du FIPV et s'en servaient comme vaccin. Les chats étaient vaccinés par voie orale ou par injection deux fois à 3 semaines d'intervalle, puis infectés par voie orale avec le FeCV pour les sensibiliser à une PIF virulente. Trois semaines après, les chats ont été contaminés par la PIF par voie orale. 4/5 des chats de contrôle non vaccinés ont succombé à la PIF, alors que 0/5 des chats vaccinés en sous-cutané avec le virus recombinant de variole du raton-laveur ont développé une PIF. L'un des cinq chats de ce dernier groupe est mort plus tard suite à une seconde infection par le FIPV, ce qui suggère que l'immunité était du type précurseur. La vaccination a induit des réponses d'anticorps sérique à la protéine de nucléocapside de FIPV, mais elles n'étaient pas neutralisantes. Cela suggère que la réponse immunitaire protectrice impliquait un mécanisme autre que la neutralisation des anticorps à la
glycoprotéine spike
ou glycoprotéine de spicule, protéine de la capside virale.
ou que la stimulation du FeCV était importante pour l'immunité. Le sort ultérieur de cette approche vaccinale est inconnu.
Dans une autre étude, le gène spike du FeCV-79-1683 a été cloné dans un virus de la vaccine qui a été utilisé
comme vecteur de vaccination (Klepfer et al 1995). Les chats vaccinés ont développé des anticorps neutralisants, mais les chatons
vaccinés avec le virus de la vaccine recombiné sont morts plus tôt que les animaux vaccinés par le virus de la vaccine natif seul. Un vaccin à plasmide contenant les gènes de la membrane (M) et de la nucléocapside (N) ont échoué à protéger des chatons contre une
infection provoquée par le FIPV (Glansbeek et al 2002), alors qu'un virus de la vaccine qui exprimait la protéine M du FIPV n'a pas
réussi à protéger des chatons contre FIPV-79-1146 (Hebben et al 2004). Un vaccin fait de lysat cellulaire de baculovirus recombinant exprimant la protéine de nucléocapside du FIPV-KU-2 a protégé 6/8 des chats vaccinés contre 1/8 des chats immunisés par un antigène de contrôle (Hohdatsu et al 2003). Haijema et al (2004) ont rapporté une vaccination réussie contre une contamination par virus homologue avec un FIPV vivant atténué par délétion des gènes 3a-c et dans une moindre étendue du 7ab.
Il n'a été fait état d'aucun suivi de recherche sur ces deux approches vaccinales.
La thérapie médicamenteuse antivirale est devenue de plus en plus importante pour de nombreuses maladies virales telles que le HIV et le virus de l'influenza humain. La Ribavirine, qui est fortement inhibitrice de FIPV in vitro (Barlough et Scott 1990), n'est pas efficace in vivo (Weiss et al 1993). Cette dichotomie entre l'inhibition in vitro et in vivo est reflétée par de récentes expériences sur le coronavirus humain SARS (Barnard et al 2006). Seize différents composés ont été testés pour leur capacité à inhiber la réplication du coronavirus félin in vitro, on a trouvé que six des composés réduisaient les titres en coronavirus de 0,401 à 0,833 (P < 0,05), en utilisant l'effet cytopathogène comme finalité. (Barlough et Shacklett 1994). Les niveaux de la dose efficace 50 dose nécessaire pour obtenir une réponse (un effet) chez 50 % des animaux (ED50) pour ces six composés était de respectivement pyrazofuine > 6-azauridine > 3-déazaguanosine > hygromycine B > acide fucidique > dipyridamole. Des composés qui n'ont eu aucun effet statistiquement significatif sur la PIF dans la même analyse étaient l'acide caféique, la carbodine, la 3-déazauridine, l'acide 5-fluoroorotique, le 5-fluorouracil, la glucosamine D(+), l'indométhacine, la D-pénicillamine, la rhodamine et la taurine. Aucune étude in vivo ultérieure n'a été rapportée sur les composés qui étaient inhibiteurs in vitro. La toute dernière survenue du SARS a beaucoup augmenté l'intérêt pour les médicaments potentiellement anti-coronaviraux et les connaissances à leur propos. On a trouvé qu'une grande variété de dérivés de N-oxyde depyridine étaient inhibiteurs du coronavirus félin (souche FIPV) et du SARS-CoV (souche de Francfort-1) dans les cultures de rein CRFK et simien (Vero) (Balzarini et al 2006a). Les composés les plus sélectifs étaient actifs à une gamme haute de l'ordre du microgramme par litre et non toxiques à 50-100 mg/L. On a montré que l'un des composés les plus actifs et les plus sélectifs testés inhibait la réplication du coronavirus au niveau de la transcription. Balzarini et al (2006b) ont aussi démontré l'inhibition des coronavirus de la PIF et du SARS humain par des dérivés semi-synthétiques d'antibiotiques glycopeptides, dont la vancomycine, l'érémomycine, la téicoplanine, la ristocétine A et la DA-40926. La concentration efficace 50 concentration de médicament produisant 50 % de l'effet maximal observé (EC50) pour les dérivés les plus actifs était dans la gamme la plus basse micromolaire. Les valeurs EC50 étaient différentes entre le FIPV et le CoV-SARS, indiquant des différences considérables dans la spécificité des espèces. A ce jour aucune étude in vivo de ces composés inhibiteurs du coronavirus félin n'a été rapportée. On a récemment trouvé que l'Indométhacine avait un puissant effet inhibiteur sur la réplication du coronavirus SARS et du CCV, mais aucune étude n'a été faite sur le coronavirus félin par ce groupe (Amici et al 2006). Cependant, une étude plus ancienne a trouvé que l'indométhacine était inefficace contre le FIPV (Barlough et Shacklett 1994).
On peut réduire l'incidence de la PIF par une bonne gestion (Pedersen et al 1995). La mortalité tend à augmenter avec la population d'animaux, notamment de chatons. L'effet de la surpopulation sur l'incidence de la PIF est particulièrement évident dans les refuges. Les pertes dues à la PIF augmentent inévitablement quand les refuges sont submergés de chats, en général à la saison des chatons, et diminue quand la surpopulation est contrôlée, des séjours plus longs en refuge aggravent la situation (K. Hurley, UC davis, information non publiée, 2008). Les pertes causées par la PIF sont aussi proportionnelles à la gravité d'autres maladies des chatons, y compris celles causées par l'herpès virus, le calicivirus, la chlamydiose, les mycoplasmes, les dermatophytoses et de nombreuses autres infections bactériennes, virales, fongiques,
par protozoaires et parasitaires de la peau, des voies respiratoires supérieures et de l'intestin. Les chatons maintenus dans des chatteries ou des refuges surpeuplés avec de nombreux autres jeunes animaux souffrent fortement des maladies concurrentes. Ces maladies stressent le système immunitaire des chatons et causent la diminution du taux de croissance et l'augmentation de la sensibilité à la maladie en général. L'infection par le virus de la leucose féline, fléau de nombre de chatteries, refuges et autres environnements à nombreux chats dans le passé, était autrefois l'élément favorisant le plus important pour la PIF chez le chat. Heureusement, l'infection par le FeLV a été rejetée dans la nature dans la plupart des pays occidentaux par une campagne agressive de test, d'isolement et d'éradication des excréteurs et de vaccination, et elle n'est plus un problème dans la plupart des milieux comportant de nombreux chats. (Weijer et al 1989). La génétique joue également un rôle important dans la PIF. Les facteurs génétiques de résistance/sensibilité affectent aussi l'incidence de la PIF et ont évidemment leur influence la plus importante dans les chatteries. On peut parfois relier les pertes dues à la PIF à certains mariages, et la continuation de l'élevage avec des couples qui ont produit des chatons affectés devrait être évitée.
Les matous qui engendrent des portées qui souffrent de la PIF devraient particulièrement être évités parce qu'un mâle donné affecte bien plus de portées et d'individus qu'une femelle (Foley et Pedersen 1996). Les pratiques d'élevage dans les chatteries résultent souvent dans l'abondance d'animaux jeunes en reproduction. On sait que l'incidence de la PIF dans une maisonnée à plusieurs chats stables diminue au-delà de 3 ans (Addie et al 1995). Cela peut être associé à une résistance acquise avec l'âge à l'excrétion chronique ou intermittente du FeCV ; une immunité de ce type se développe sur une période de nombreux mois ou années (Pedersen et al 2008). On constate une résistance liée à l'âge sur cette période de temps pour plusieurs infections chroniques comme l'herpès virus, le FCV, le FeLV et la teigne. C'est pour cela que les chatteries ou les élevages qui ont essentiellement des chats plus âgés ont bien moins de problèmes de maladies infectieuses que les chatteries avec de jeunes chats de reproduction ou les animaux de refuges.
On a plaidé pour la pratique qui consiste à isoler les femelles et à sevrer précocement les chatons pour le contrôle de la PIF dans les chatteries (Addie et al 2004, Addie et Jarrett 1995) et elle est largement utilisée. Les chatons de chatterie ne sont pas infectés par le FeCV avant 9 à 10 semaines (Pedersen et al 2008). Si les femelles sont isolées juste avant la parturition, maintenues en stricte quarantaine d'autres sources d'exposition au FeCV, éloignées de leurs chatons dès que possible (4 à 6 semaines après la naissance) et que les chatons sont ensuite maintenus en isolement, il est possible d'empêcher que les chatons soient infectés par le FeCV de donc de prévenir la PIF.
Cependant, cette pratique marche le mieux dans de petites chatteries, et dans des chatteries ou des groupes d'élevage plus importants elle nécessite des installations de quarantaine très élaborées et un strict contrôle de l'exposition (Hickman et al 199 ?).
La poussière de litière brute et microscopique contient des taux élevés de virus. Cette poussière de litière est omniprésente et se répand facilement par l'air, les cages, les récipients, les accessoires et sur les vêtements. De ce fait, une quarantaine stricte implique des quartiers et des soigneurs séparés, des litières, des récipients pour l'eau et la nourriture séparés, de l'air différent et un changement de vêtements de protection à l'entrée et à la sortie, y compris pour les chaussures, les protections de chaussures, les bottines, des pediluves etc. Des installations d'isolement ne peuvent pas consister en une simple autre pièce dans une maison, sans aucune autre précaution spéciale. Si on ne peut pas avoir de pièce d'isolement conçue pour cela, on peut en alternative transférer les chatons en sevrage précoce dans des infrastructures ou des maisons distantes et dépourvues d'autres chats.
Le problème de «l'isolement des chattes gestantes et le programme de sevrage précoce» est à plusieurs volets. Tout d'abord, le niveau de quarantaine requis pour empêcher la contamination nécessite des installations onéreuses et des coûts élevés pour leur utilisation. Ensuite, que doit-on faire avec les chatons sans coronavirus après les avoir élevés ? L'infection par le coronavirus est quasiment assurée dès que ces chatons seront réintroduits dans un environnement normal et auront des activités normales, comme le placement dans une nouvelle maison, les expositions et la reproduction. Cependant, il reste un avantage à un isolement et un programme de sevrage précoce réussis, c'est de retarder l'infection jusqu'à ce que les chatons aient 16 semaines ou plus. C'est une période à laquelle le système immunitaire commence à atteindre des niveaux d'activité adultes et que les chatons deviennent plus résistants à des maladies cliniques de toutes sortes, y compris la PIF.
Les chatteries qui peuvent entreprendre un programme d'isolement et de sevrage précoce doivent déterminer si cela fonctionne étant donné leurs installations et leur niveau de gestion. Si des chatons issus d'un programme de sevrage précoce s'avèrent séropositifs à 16 semaines et/ou excréteurs de FeCV dans les fèces, le programme a échoué. Etant donné les coûts et les problèmes logistiques, l'auteur ne recommande pas fortement les programmes d'isolement et de sevrage précoce, notamment pour les grandes chatteries (plus de 6 chats en reproduction). Les meilleurs moyens en rapport prix/efficacité de contrôler les pertes dues à la PIF sont de 5 ordres :
- éliminer la surpopulation et si possible ne pas avoir plus de 6 animaux en reproduction ;
- maintenir une forte proportion de chats plus âgés (3 ans et plus) ;
- gérer le passage des fèces à la bouche en gérant correctement les bacs à litière, le remplacement de la litière, et la propagation microscopique et autre de la litière et de la poussière de litière ;
- être très sélectif dans son programme d'élevage et produire un nombre minimum de portées et
- contrôler la génétique en n'utilisant aucun mâle (au minimum) qui a engendré des chatons qui ont développé une PIF, ou de préférence n'utiliser aucun mâle ni aucune femelle qui ait engendré des chatons qui sont morts de la PIF.
Ces mesures sont bien plus efficaces qu'un programme d'isolement et de sevrage précoce mal mené et elles peuvent être instaurées facilement.
7. Immunité naturelle
L'immunité naturelle à la forme mutante du FeCV (i.e le FIPV) existe si on se base sur des études expérimentales. Pratiquement toute étude qui implique une infection expérimentale par la PIF, qu'elle concerne un vaccin ou des aspects de la pathogenèse, montre des chats qui survivent à de très fortes expositions à un virus très virulent. Comme les facteurs de gestion des chats sont largement standardisés dans de telles études, la résistance ou la sensibilité peuvent être réduites à un seul facteur : la capacité individuelle du chat à établir une réponse immunitaire forte et durable au FIPV. L'immunité naturelle est loin d'être aussi évidente quand on s'occupe de cas de PIF de terrain, car virtuellement tous les chats qui deviennent cliniquement malades de cette maladie mourront dans un laps de temps compté en jours, semaines, mois et parfois années.
Les observations faites à partir de la maladie qui se déclare naturellement peignent un tableau bien plus pessimiste. Cependant, on doit réaliser que les chats qui développent la PIF sur le terrain et dans nos maisons sont ceux qui ont échoué à construire une réponse immunitaire efficace et durable. Ils ont déjà perdu leur combat personnel, tout comme la proportion de chats qui meurent suite à une infection expérimentale.
Alors quels sont les facteurs qui feront pencher la balance de la réponse immunitaire au FIPV en faveur de l'hôte ?
Les facteurs génétiques (Foley et Pedersen 1996) et ceux particuliers à l'hôte (Poland et al 1996) semblent avoir une forte influence sur la résistance à la sensibilité au FIPV dans la nature. Il est indubitable que les facteurs de résistance génétiques impliquent plus d'un gène et probablement plusieurs gènes agissant de concert. Sur la base des études génétiques sur la résistance humaine aux infections et à l'auto-immunité, la plupart des gènes de résistance sont impliqués, avec divers aspects de reconnaissance et de régulation immune. Bien que de nombreux gènes puissent en fin de compte être liés à la résistance/sensibilité, c'est probablement une poignée de gènes qui joue un rôle majeur et sert de base à la sélection génétique pour la résistance.
Il semble que les facteurs environnementaux comptent pour la moitié de l'incidence de la PIF. Cependant, l'identité de ces facteurs est incertaine. Les pertes dues à la PIF sont sans aucun doute plus élevées chez les chats qui ont passé leur première enfance dans des maisonnées avec de nombreux chats, telles que des chatteries, des refuges et des familles d'accueil. La surpopulation et le brassage de chatons, chats adolescents et plus âgés sont une caractéristique commune à ces environnements et contribuent de manière évidente aux autres infections des chats. L'âge auquel un chaton est exposé au FeCV est probablement aussi crucial. La plupart des chatons ne présenteront aucun signe d'excrétion du FeCV avant l'âge de 9 semaines, montrant qu'ils peuvent être infectés une semaine avant (afin de compter la période d'incubation). Nous savons que la mutation du FIPV se produit chez jusqu'à 20% des chats qui subissent une infection primaire par le FeCV (Poland et al 1996), mais que seule une partie de ces chatons développera une PIF. L'âge est probablement l'un des plus importants facteurs de risque outre l'exposition au FeCV et la sensibilité génétique. Nous savons que des chats matures exposés au FeCV, avec un système immunitaire normal, ne seront pas malades. A l'opposé, un chat mature sur 5 exposé au FeCV de la même façon et en même temps avec un système immunitaire déficient, développera une PIF. Nous savons aussi que les jeunes chatons excrètent de 10 à 100 fois plus de FeCV suite à l'infection primaire que les chats matures. Plus le taux de réplication du virus dans l'intestin est élevé, plus la probabilité de mutation est élevée. Enfin, nous savons que les chatons dans la tranche d'âge de 8 à 12 semaines commencent tout juste à devenir immunocompétents et que le niveau d'immunité quasi adulte n'est pas atteint avant 16 semaines ou plus. De ce fait, la plupart des chatons de chatteries et de refuges sont exposés au FeCV, et donc à ses mutants, à un âge où ils ne sont pas pleinement immunocompétents. Si cette infection est reculée de plusieurs semaines ou plusieurs mois, la probabilité de colonisation de l'hôte par le mutant du FIPV est indubitablement énormément réduite.
Le FeLV est un puissant potentialisateur de PIF. On a observé 35 cas de PIF chez 500 chats de référence qui avaient été infectés de manière expérimentale par le FeLV par contact naturel ou infection expérimentale ([Pedersen et al 1977] et [Pedersen 1987a]). Les décès dus à la PIF se sont produits relativement peu de temps après qu'ils soient devenus virémiques au FeLV et seul un chat dans un groupe similaire de chats non exposés au FeLV est mort de PIF. Les titres en anticorps au FIPV ont commencé à augmenter progressivement après que les chats soient devenus virémiques au FeLV et ont atteint des niveaux élevés avant la mort par PIF. (Pedersen 1987a)
8. Considérations de santé publique et animale
Le virus de la péritonite infectieuse féline cause une infection qui se produit naturellement chez les félidés domestiques et sauvages. Les humains ne sont pas hôtes du virus. Les chiens et les porcs peuvent être infectés expérimentalement par le FIPV. L'un des premiers vaccins commerciaux contre les coronavirus destiné aux chiens était peut-être en réalité fait de FIPV ; des centaines de chiens sont morts de maladies neurologiques et du pancréas très graves avant qu'il ne soit rappelé (Martin, 1985). Cependant, le fait que très peu de chats, voire aucun, atteints de PIF excrètent le FIPV limite non seulement sa transmission de chat à chat mais aussi de chat à chien. De ce fait, on n'observe pas d'infections de chiens par le FIPV dans la nature. On constate un syndrome proche de la gastro-entérite transmissible de gravité faible à assez sévère chez les porcelets (Woods et al 1981). Cependant, il est douteux que la PIF soit une cause de maladie naturelle chez ces espèces. Des maladies ressemblant beaucoup à la PIF des chats et causées par des coronavirus liés aux espèces, ont été décrites chez les furets ([Garner et al 2008], [Perpinan et Lopez 2008] et [martinez et al 2008]) et les souris ([France et al 1999] et [Kyuwa et al 1998a, b]).

Comprendre la péritonite infectieuse féline. Entretien avec le Dr Pedersen ; des questions-réponses pour une synthèse de ce synopsis.